基礎研究と臨床研究では、それぞれ、必要な研修や研究を実施するまでの手続きが異なります。
基礎研究
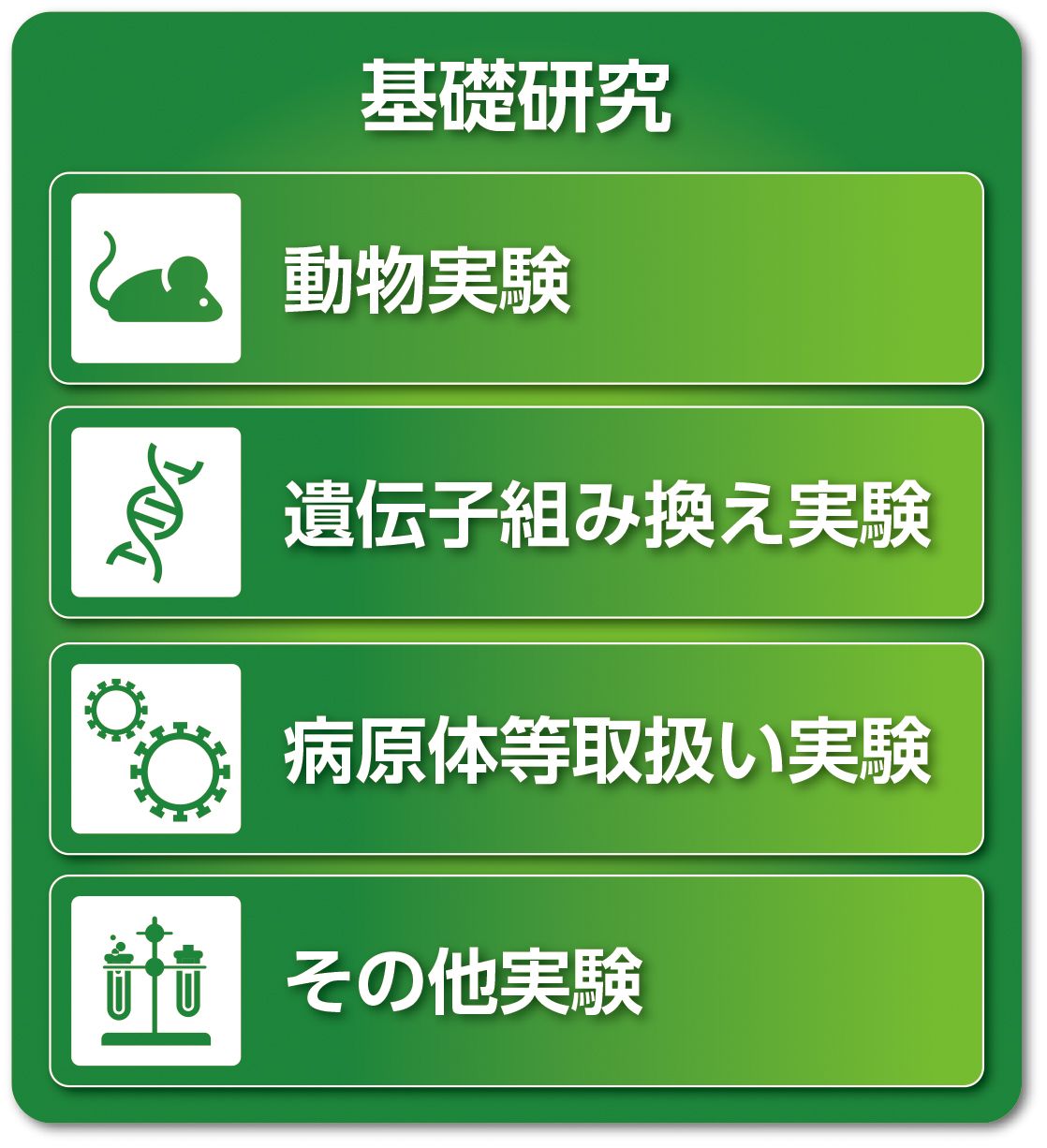
必要な研修・手続き
- 遺伝子組み換え実験
- 病原体等取扱い実験
- 動物実験
- RI(放射性同位元素)実験
研究機器・設備の利用
- 医学部:総合医学研究センター
- 薬学部:総合薬学研究センター
安全管理
- 化学物質管理
- 廃棄物分別
- 実験環境安全管理(医学部)
問い合わせ先
実験の種類によって、問い合わせ先が異なります。
以下がそれぞれの問い合わせ先です。
| 実験の種類 | 問い合わせ先 | ||
|---|---|---|---|
| 部署 | 内線 | ||
| 遺伝子組み換え実験 病原体等取扱い実験 |
医学部)研究推進課 薬学部)薬学総務部管理課 |
2008 604、219 |
biosafety(at)ompu.ac.jpp-kenkyu(at)ompu.ac.jp |
| 動物実験 | 医学部)病態モデル先端研究部門 薬学部)薬学総務部管理課 |
2659 604、219 |
eac000(at)ompu.ac.jpp-kenkyu(at)ompu.ac.jp |
| RI実験 | 薬学部)薬学総務部管理課 | 604、219 | p-kenkyu(at)ompu.ac.jp |
| 研究機器・設備 | 医学部)研究機器部門 薬学部)薬学総務部管理課 |
3401 604、219 |
crlkikou(at)ompu.ac.jpp-kenkyu(at)ompu.ac.jp |
| 実験環境安全管理 | 医学部)研究推進課 薬学部)薬学総務部管理課 |
3405 213、220 |
sps000(at)ompu.ac.jpp-sisetu(at)ompu.ac.jp |
※ E-mailは迷惑メール防止のため「@」を「(at)」に変換しています。
臨床研究
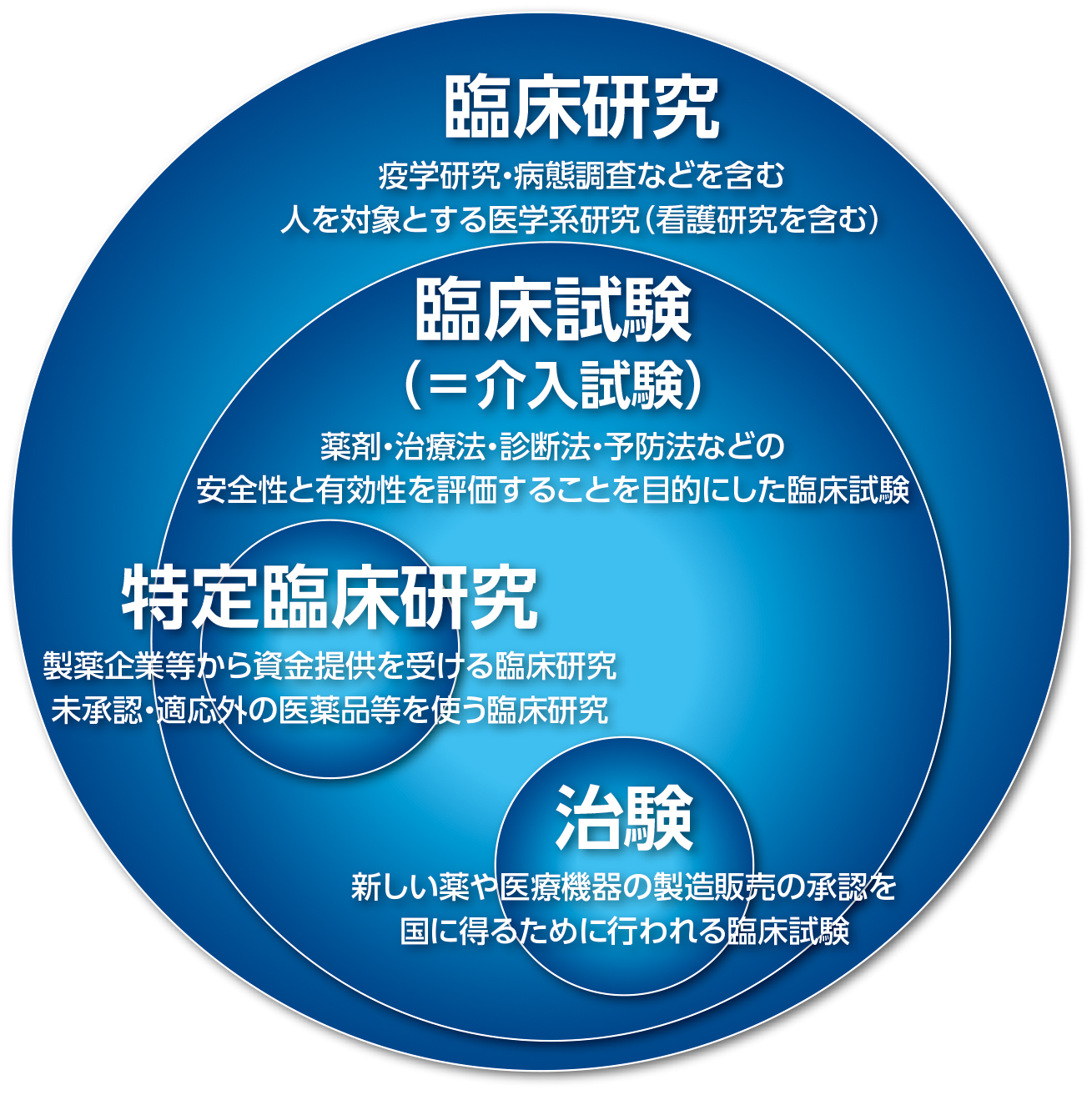
人を対象とする医学系研究を実施する場合、 研究対象者の人権擁護のため、 研究者は、研究の倫理的妥当性及び科学的合理性が確保されるように研究計画書を作成し、 倫理審査委員会の審査にて承認後、研究機関もしくは実施医療の機関の長の許可を受け、 研究計画に即して研究を遂行することが求められます。 研究計画に準じて研究を遂行しなければ、「逸脱行為」としてみなされます。
臨床研究を始めるための必要な手続き
各審査委員会
| 分類 | 審査委員会 | 事務局(内線/E-mail) | |
|---|---|---|---|
| 臨床研究 | 研究倫理委員会 | 研究推進課(内線2904) | rinri(at)ompu.ac.jp |
| 臨床試験(治験・特定臨床研究を除く) | 研究倫理委員会 | 研究推進課(内線2904) | rinri(at)ompu.ac.jp |
| 特定臨床研究 | 臨床研究審査委員会 | 研究推進課(内線2039) | ompu_rinsyou(at)ompu.ac.jp.jp |
| 治験 | 治験審査委員会 | 臨床研究センター(内線2257) | ompu_chiken(at)ompu.ac.jp |
※ E-mailは迷惑メール防止のため「@」を「(at)」に変換しています。
臨床研究を計画するにあたり、臨床研究コンシェルジュがご相談に乗ります。お気軽にお問合せください。
詳しくは、こちらをご参照ください。【臨床研究センターホームページ】