臨床研究法の対象となる研究
臨床研究法上の「臨床研究」
「医薬品等を⼈に対して⽤いて、当該医薬品等の有効性⼜は安全性を明らかにする研究(治験を除く)」
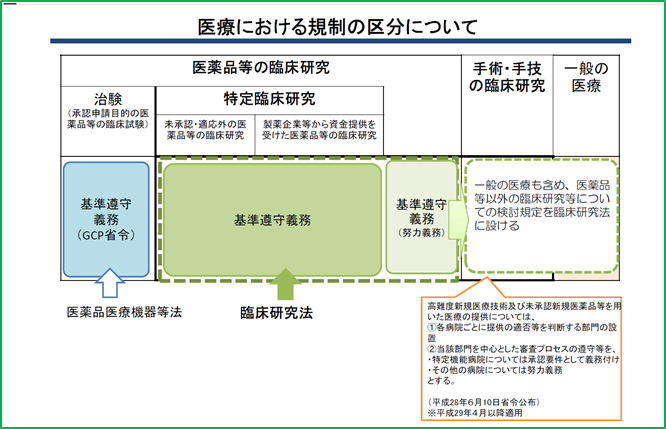
「特定臨床研究」
●国内で未承認・適応外※の医薬品等
(薬機法上の医薬品、医療機器、再⽣医療等製品)を⽤いて⾏われる臨床研究
●製薬企業等から資⾦提供を受けた医薬品等の臨床研究
※医薬品等の「適応外使⽤」とは
下記事項に関し、適応(承認)とされた範囲を超えるもの
① 医薬品︓⽤法、⽤量、効能及び効果
② 医療機器︓使⽤⽅法、効能及び性能
③ 再⽣医療等製品︓⽤法、⽤量、使⽤⽅法、効能、効果及び性能
臨床研究実施基準の遵守
特定臨床研究を実施する際には、法令の定める臨床研究実施基準を遵守することが求められます。
・実施計画を厚生労働大臣へ提出
・実施計画の遵守
・研究対象者から同意取得
・認定臨床研究審査委員会への疾病等報告等
届出義務と認定臨床研究審査委員会
研究実施者には、厚労省への実施計画の届出と、臨床研究法上の認定臨床研究審査委員会による審査が義務付けられています。また、厚生労働大臣に対し、実施状況及び疾病等の報告を行なうことが定められています。
資金提供規制
製薬企業等が自社製品を用いた特定臨床研究に、法律で定める研究資金等を提供する場合、その額及び内容、当該研究の内容等の事項を定めた契約を締結しなければならず、当該企業には資金の提供に関して公表義務※が発生します。
※公表の対象となる資金提供の例:研究費(臨床)、寄付金、執筆料、謝金等
特定臨床研究以外の医薬品等の臨床研究
医薬品等の臨床研究のうち、特定臨床研究(及び治験)以外の研究も努力義務が課され、特定臨床研究に準じた取り扱いが求められます。
改善・停止命令と罰則
実施計画を提出しない、記録を保存しないなどの遵守義務違反に対して、厚労省は改善・停止命令が可能となり、命令に従わない場合、罰則(50万円以下の罰金)が科されます。緊急命令違反は、刑事罰(3年以下の懲役もしくは300万円以下の罰金)も科されます。
罰則について
臨床研究法において、罰則は以下のように定められています。
| 違反内容 | 罰則の対象 | 罰則内容 | 記載箇所 |
| 厚生労働大臣の緊急命令(法第19条の規定)に違反した場合 | 違反者 | 3年以下の拘禁刑もしくは300万円以下の罰金 | 法第39条 |
| 厚生労働大臣の緊急命令(法第19条の規定)に違反した場合 | 1年以下の拘禁刑もしくは100万円以下の罰金 | 法第40条 | |
| 実施計画について(法第5条1項及び6条1項の規定) ・正当な理由なく提出しな かった場合 ・記載すべき事項を記載し なかった場合 ・虚偽の記載をした場合 |
特定臨床研究を実施する者 | 50万円以下の罰金 | 法第41条1項1号 及び2号 |
| 記録の作成と保存について(法第12条の規定) ・正当な理由なく記録の作 成または保存をしなかっ た場合 ・虚偽の記載をした場合 |
法第41条1項3号 | ||
| 厚生労働大臣の改善命令(法第20条2項の規定)に違反した場合 ・正当な理由なく記録の作 成または保存をしなかっ た場合 ・虚偽の記載をした場合 |
法第41条1項4号 | ||
| 厚生労働大臣による報告徴収及び立入検査 (法第35条1項の規定)について ・正当な理由なく報告又は 物件の提出をしなかった 場合 ・虚偽の報告又は虚偽の物 件の提出をした場合 ・立入検査を拒み、妨げた 場合 ・立入検査を忌避した場合 ・質問に対し答弁をしなか った場合 ・質問に対し虚偽の答弁を した場合 |
法第41条1項5号 | ||
| 医薬品等製造販売業者その特殊関係者 | 30万円以下の罰金 | 法第42条 |
