はじめに

口腔や腸管に存在する多様な常在菌は、生理・免疫機能に影響を及ぼすことで、私たちの健康維持に深く関わっていると考えられていますが、そのメカニズムの全容はまだ明らかになっていません。
大阪医科大学では、私立大学研究ブランディング事業選定プロジェクト*において口腔内細菌叢に着目していることから、細菌叢研究の最前線で活躍する理化学研究所の服部正平先生、須田亙先生を招聘し、学内シンポジウムを開催しました。
当日は、学内から多くの若手研究者が参加し、細菌叢研究についてそれぞれの分野から興味・関心を持って、最新の知見に触れる姿が見られました。本レポートでは、当日のようすを一部抜粋にてお伝えします。
*オミックス医療に向けた口腔内細菌叢研究とライフコース疫学研究融合による少子高齢中核市活性化モデル創出、通称「たかつきモデル」
「ヒトマイクロバイオームの解析手法論」(須田亙先生)

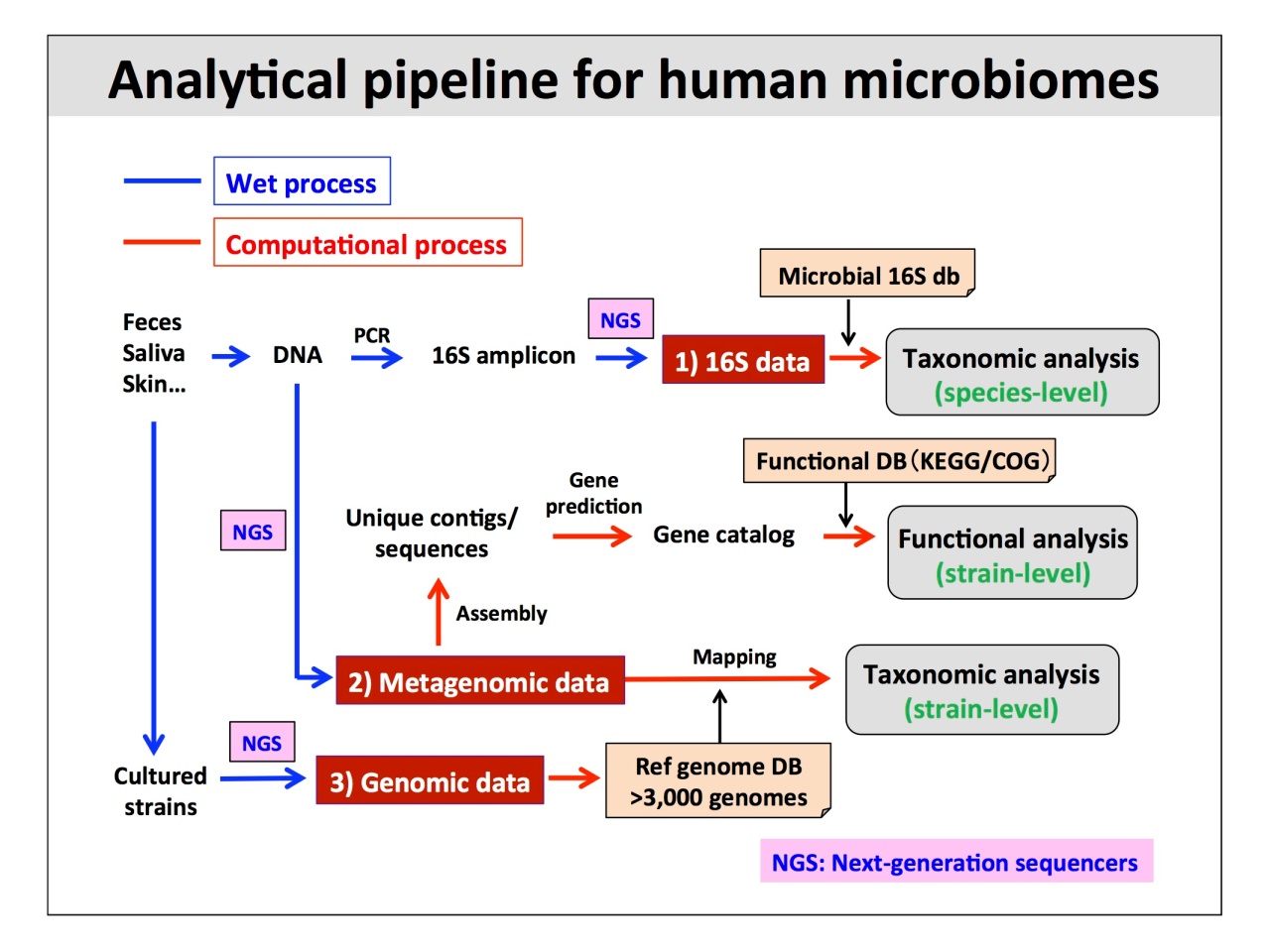
須田先生は腸内細菌叢の研究が始まった1960年代にさかのぼって解析法の推移を解説。細菌叢研究を飛躍的に進歩させた、次世代シークエンサー(NGS)を用いて行う「メタ16S解析」「メタゲノム解析」「個別ゲノム解析」について、最新の研究事例を交えて詳細に紹介されました。
解析精度に関連するエラー評価については、「Mockで既知の細菌種を合成した細菌叢をNGSで解析した結果、エラー率は0.5%程度」とのこと。さらに、エラーが解析結果にどのように影響するか、シミュレーションした結果なども示されました。
得られたデータを解析するうえでは、ヒト常在菌のデータベースが重要になります。2007年に発足したIHMC(International Human Microbiome Consortium)は、世界規模で身体の各サイトの菌とそのDNA塩基配列の登録を進めており、「現在では約8割が解釈可能な結果が得られる」状況にあるそうです。
最後に、情報解析の前段階にある、試料となる糞便の理想的最適な採取・保存方法についても紹介されました。腸内細菌の解析に使われるDNAを抽出する、ビーズ法、熱処理、酵素溶菌法の3種類の方法について、DNA抽出の効率を推し量る手法として、溶菌効率に着目したプロトコール比較も示されました。
試料となる糞便については、フレッシュな検体であればあるほど理想的。-80℃液体窒素による瞬間凍結やRNAlater等の保存溶液による固定保存などが行われています。須田先生は、保存を経ないフレッシュな便と様々な方法で保存した便をメタ16S解析によって比較した結果を示し、「RNAlaterで保存した便は非常にフレッシュ便に近い菌層構造になる」と述べられました。
解析に必要な検体とDNAの量については「メタ16S解析には500ngのDNAがあれば充分であり、ロングリードシークエンサーを用いたメタゲノム解析においても耐えうる量」とのこと。最後に、「世界各国の主要な腸内細菌層メタゲノム解析の報告」と「ロングリードシークエンサーを用いたメタゲノム解析」に関するデータが示されました。
「健康と疾患のヒトマイクロバイオーム解析」服部 正平 先生
服部正平先生の講演では、健康と疾患、あるいは国、ライフスタイル、食習慣によって、ヒトマイクロバイオームはどう変化するのか、ヒトマイクロバイオームと各疾患の関わりについて、最新の研究事例を交えながらお話されました。
国際的に主流となりつつある「メタゲノム解析」
服部先生
「ヒトマイクロバイオームの研究の流れには、2つの大きな車輪があります。一つはヒトから試料を採取してどんな菌がいるのか(who’s there)を調べてデータベースをつくること。もう一つは、常在菌の機能解析です。私の技術的な背景は前者にあり、後者の先生方と共同研究を行っています」。
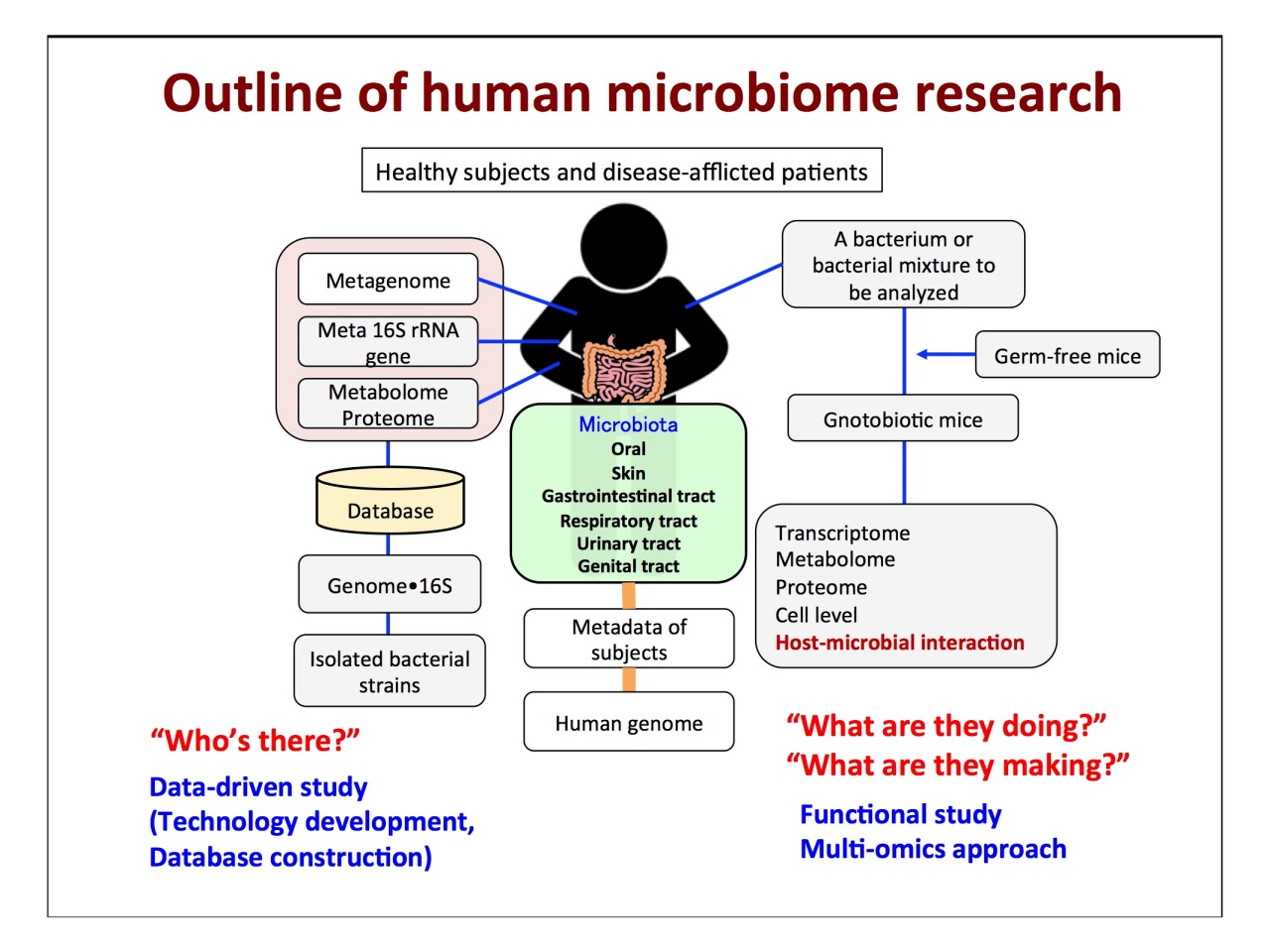
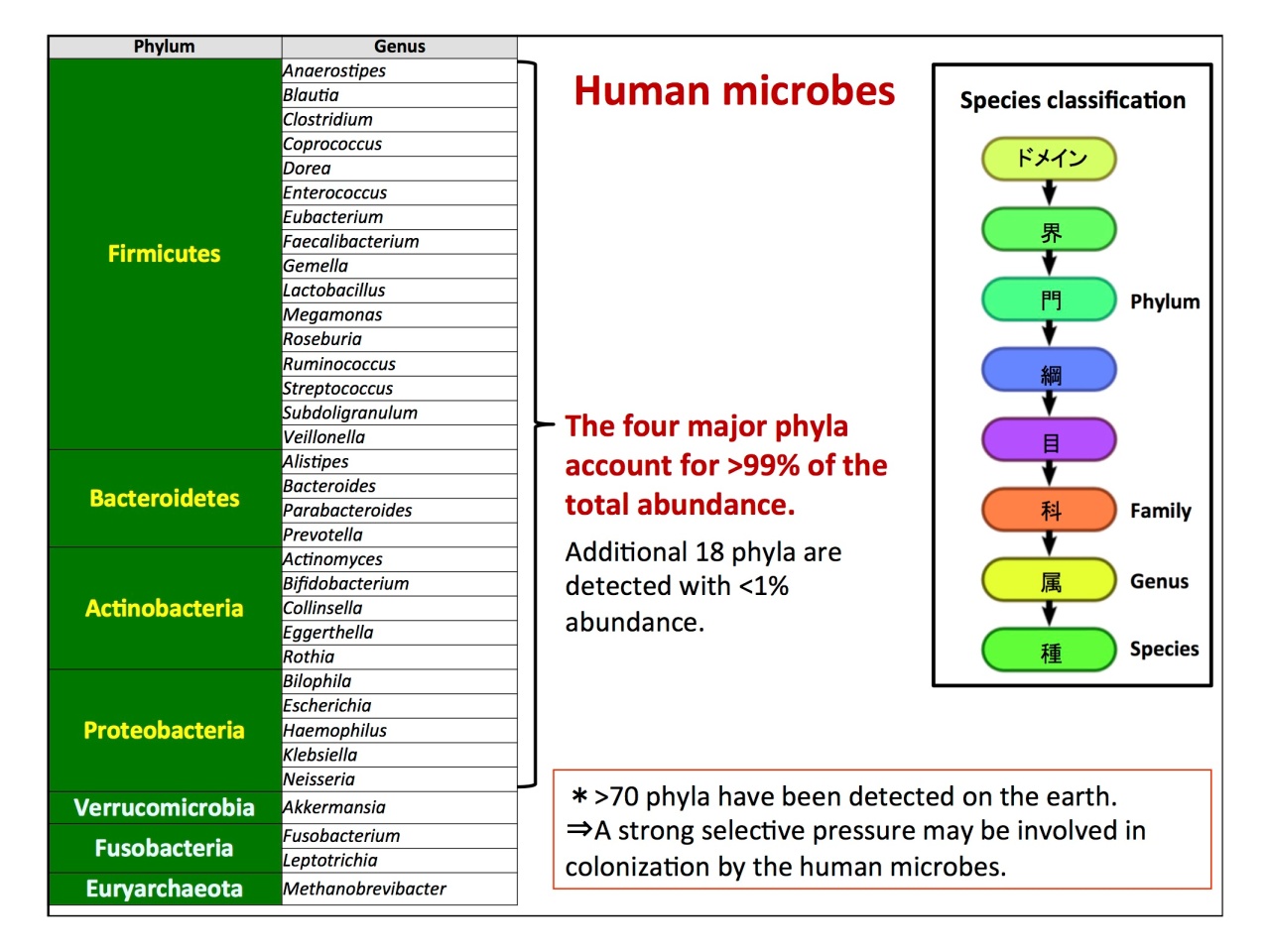
現在は、「国際的な方向性としてメタゲノムが主流になりつつある」とのこと。次世代シークエンサー(NGS)による解析データから明らかになった、ヒトの細菌分類が示されました。
服部先生
「地球上には70門の細菌が見つかっており、ヒトの常在菌は99%が4門に属していることがわかりました。菌のセレクションは種類ではなく、菌が持っている機能にかかっています」。
食習慣と腸内細菌層は必ずしも一致しない
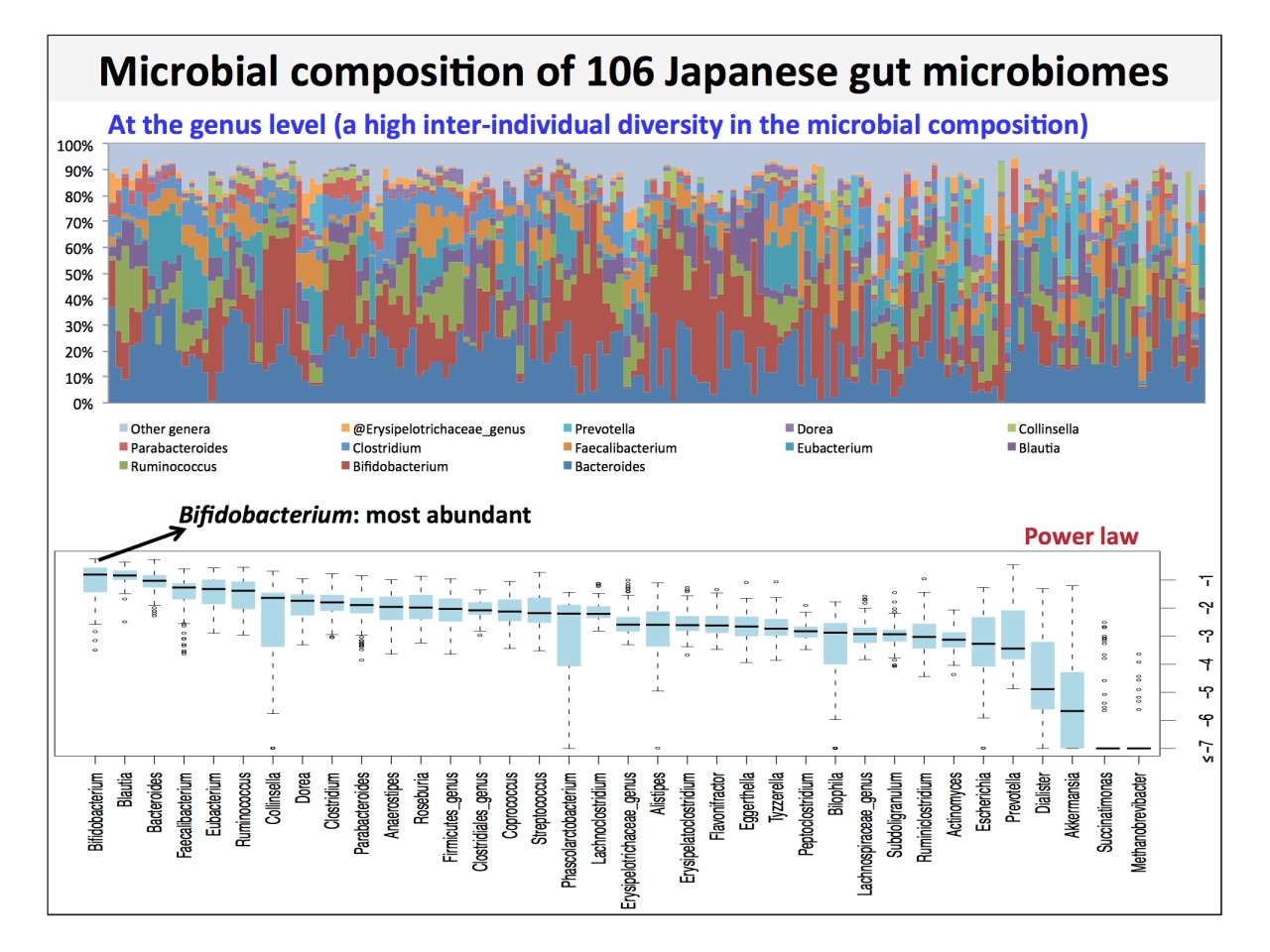
常在菌叢の菌種組成は、「棲息部位ごとの類似性」「個人間の多様性が大きい」「3歳以上は平均的な大人の菌叢に似ている」などが、データで示されました。また国別の比較については、2016年に発表したデータを紹介。
服部先生
「日本人106人で見ると属レベルの組成はバラバラです。ところが、平均をとってboxplotでどういう属が多いかを図で示すと、日本人はBifidobacterium、Blautia、Bacteroidesの3つが基本的に多いということがわかります」。
また、日本を含む12カ国の、健康な861名のデータを比較すると、国ごとにも菌種組成が異なることが明らかです。
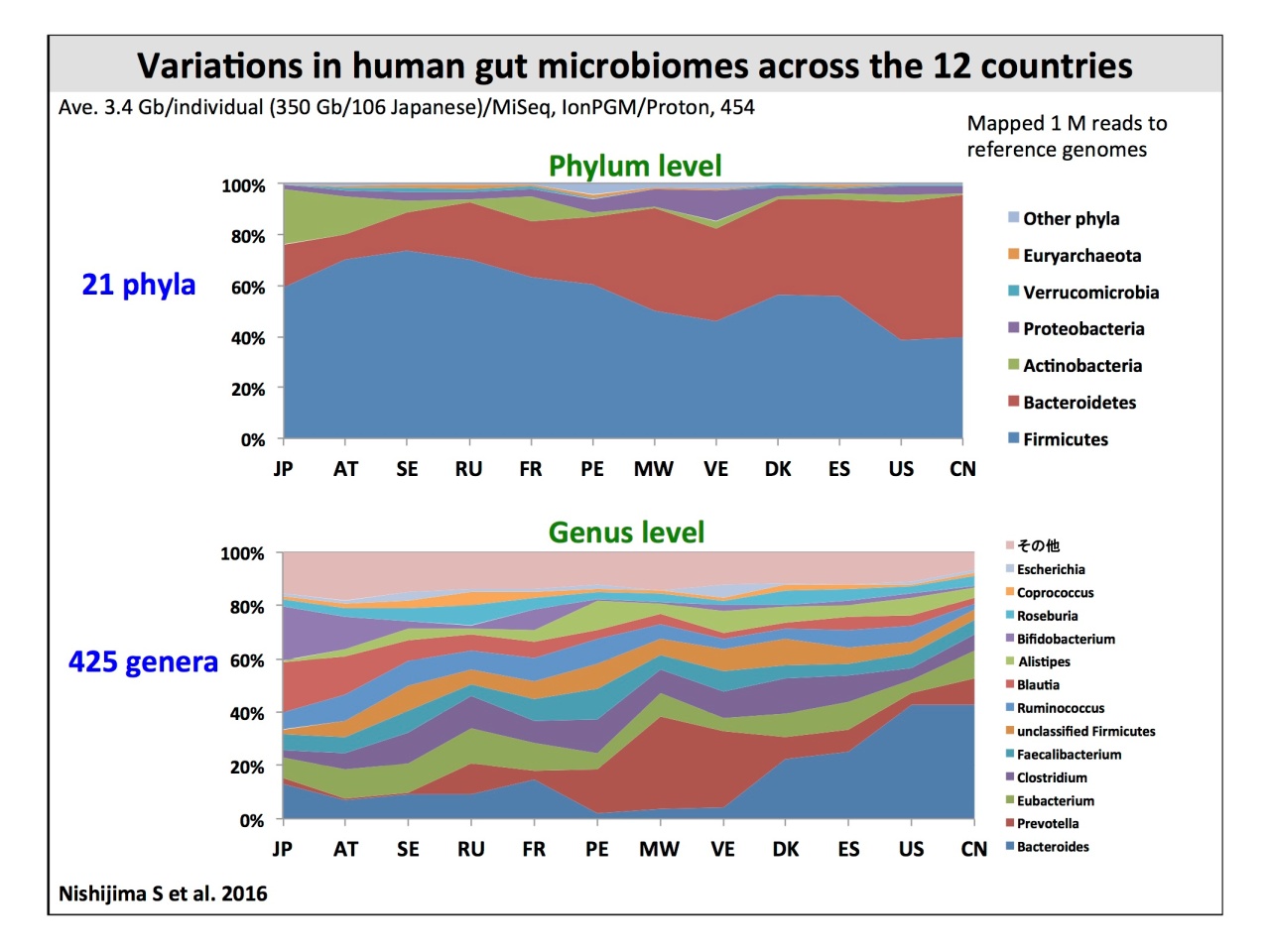
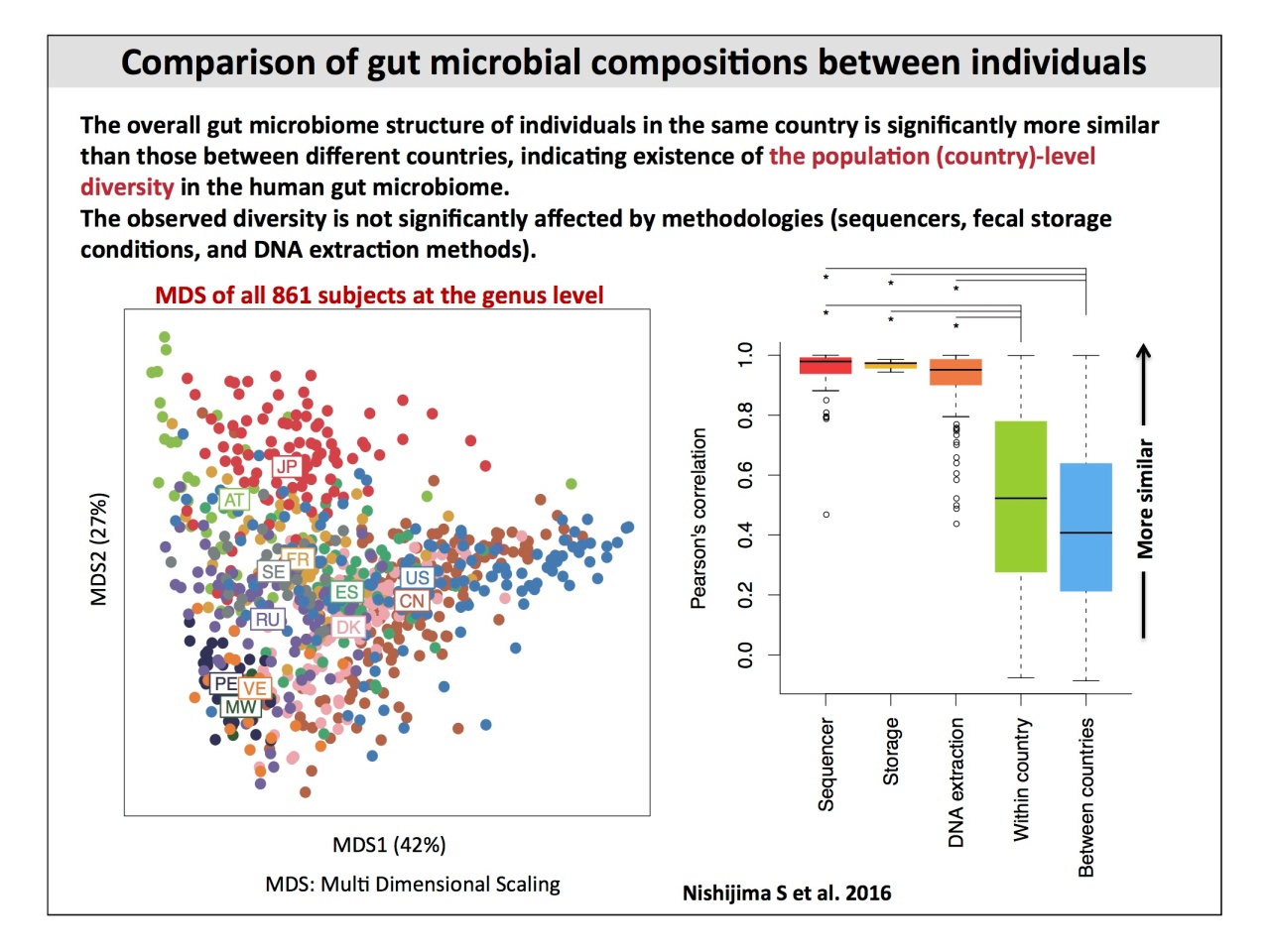
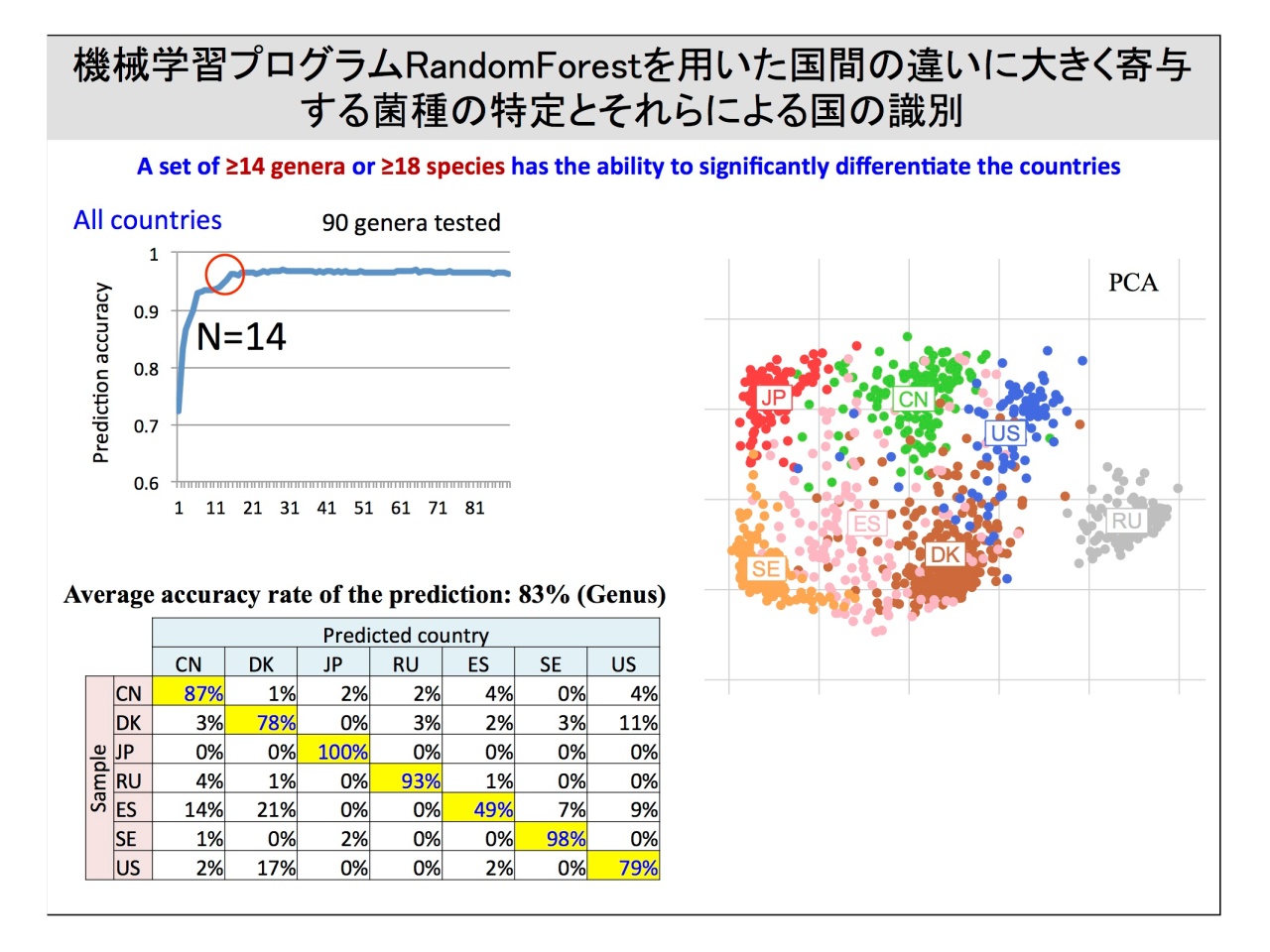
階層式クラスタリングによって12カ国の菌叢の類似性を見ると、Prevotellaが多いマラウィ・ヴェネズエラ・ペルー、Bacteroidesが多いアメリカ・中国・デンマーク・スペイン・ロシア、そしてBifidobacteriumが多いスウェーデン・フランス・オーストリア・日本と、大きく3つのクラスタに分かれます。
服部先生
「このクラスタを見て多くの人が疑問に思うのは『なぜ、中国と日本は食べ物が似ているのに全く違うのか?』『なぜ、アメリカと中国が一番似ているのか?』ということ。今までのイメージと違っているわけですね」。
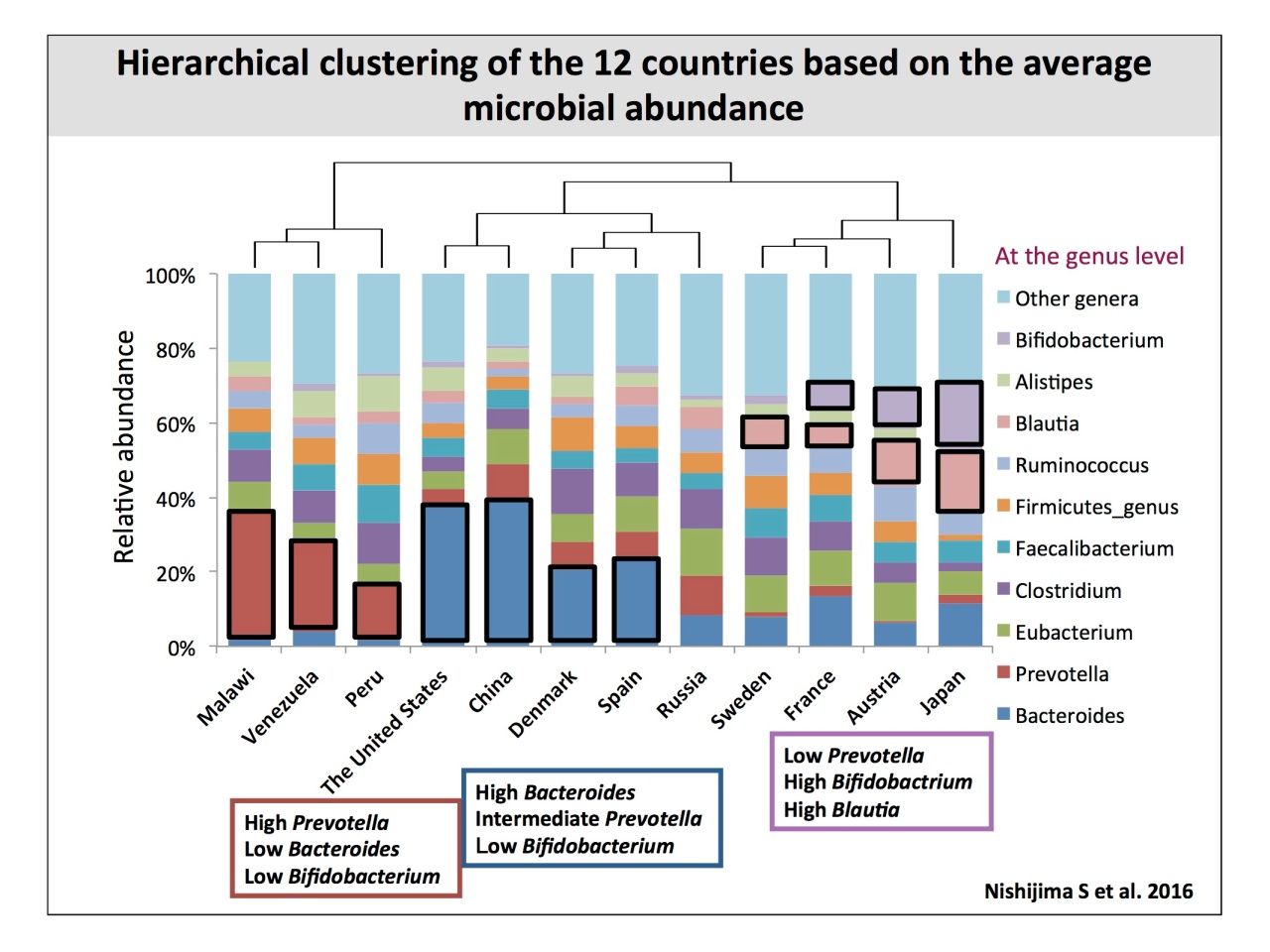
そこで、腸内細菌層に影響する食事について、FAOSTAT(国際農林業恊働協会の統計)から、2003〜2014年のデータ平均を調査。たんぱく、脂質と炭水化物の比率を出してクラスタリングすると、アジア、南米、アメリカと北米および西洋諸国の大きく2つのクラスタに分かれたそうです。
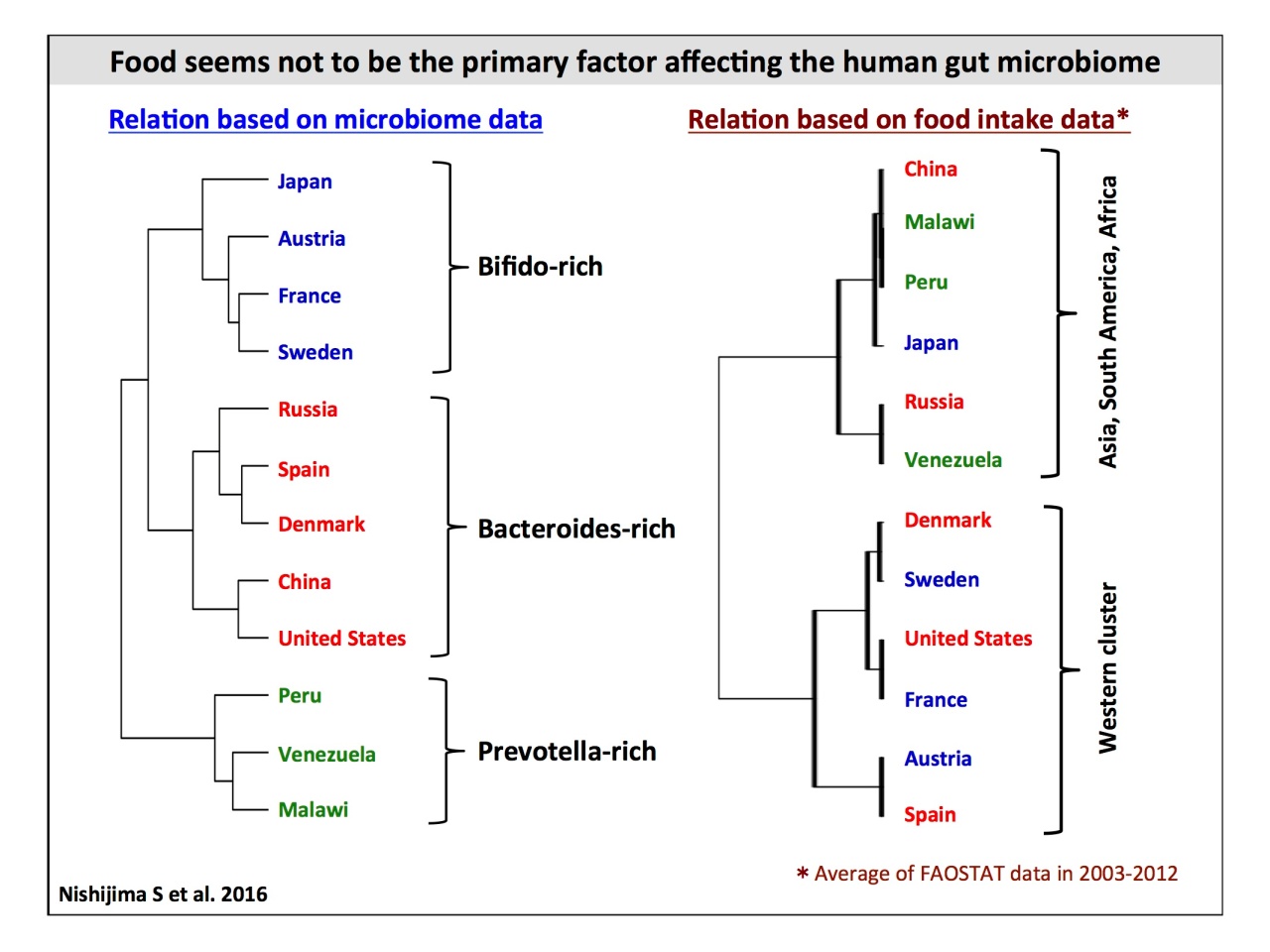
服部先生
「もし、食事が大きく腸内細菌に影響しているのであれば、この対応は一致しなければいけない。しかしながら、食事と腸内細菌の相関関係は、あったりなかったりでバラバラでした。そこで、総持寺(曹洞宗)の僧堂で精進料理を食べて生活する禅僧たちと、同じ年齢の健康の菌叢の違いを調べましたが、驚いたことに菌の区別は見られませんでした」。
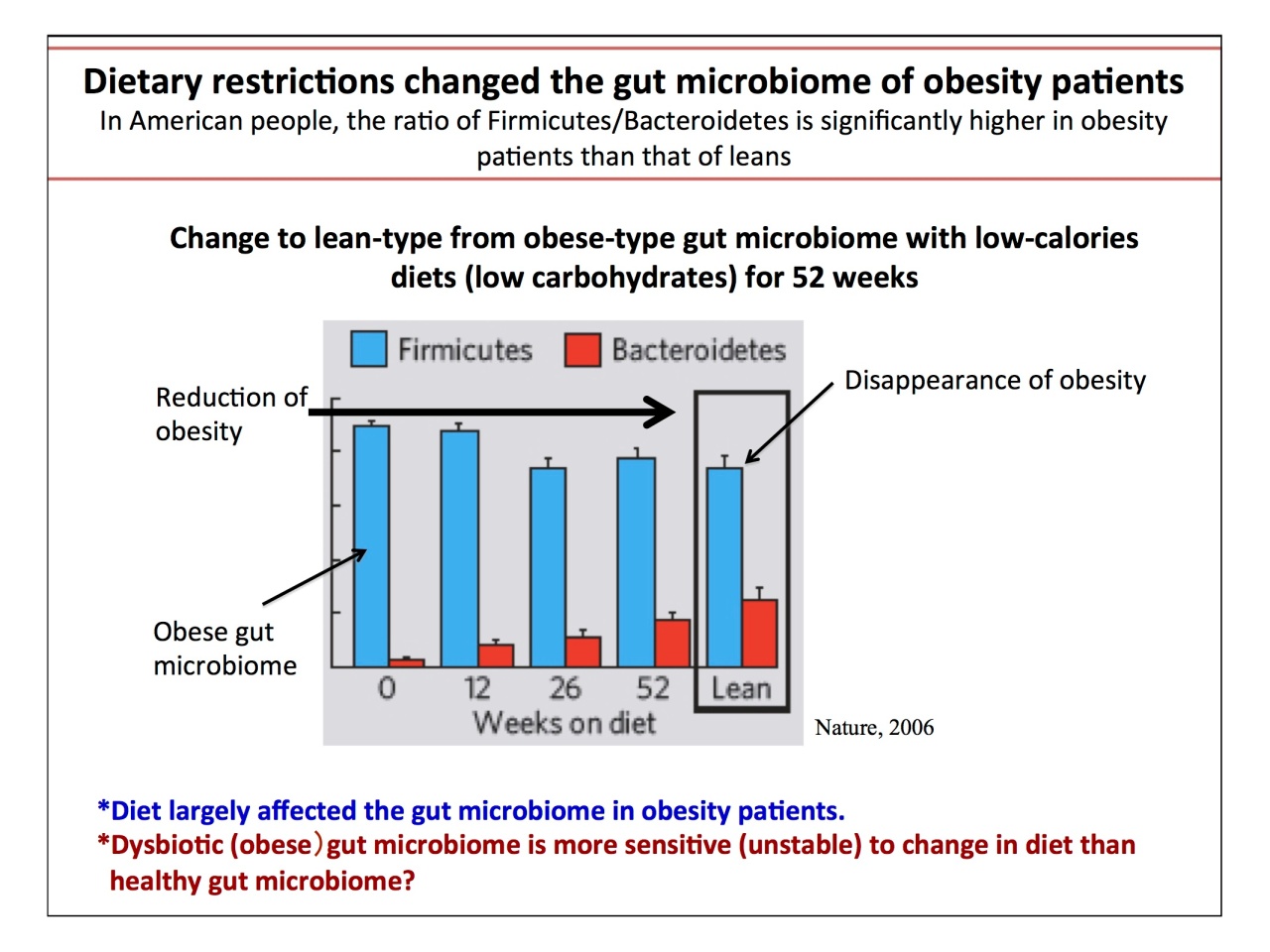
一方、肥満のヒトが52週(1年)のダイエットをして成功したケースにおいて、腸内細菌の推移を見ると、肥満型から健康型に変化しましたが、「食事が腸内細菌を変えてはいるが健康の菌叢ではない」と服部先生。多くの論文は、食事が腸内細菌に影響を与えると考えるが、「影響を受けるのは病態であり、健康な腸内細菌叢と食習慣が一致しないのは当然」と説明されました。
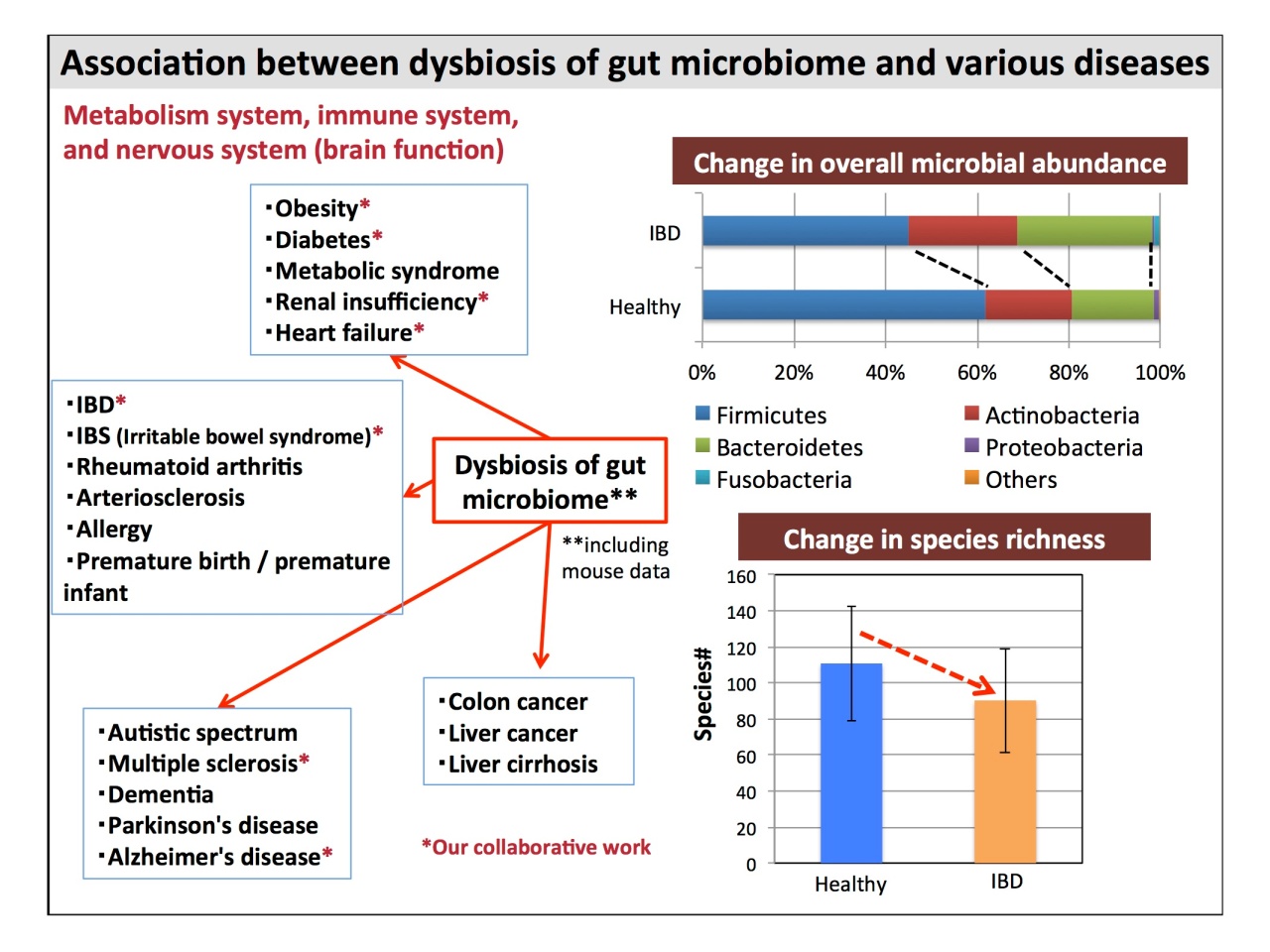
さまざまな疾患と腸内細菌層のdysboiosisにも高い相関関係が見られましたが、「病気になったから菌が変わったのではない」と服部先生。「菌が疾患を起こしている」と言います。
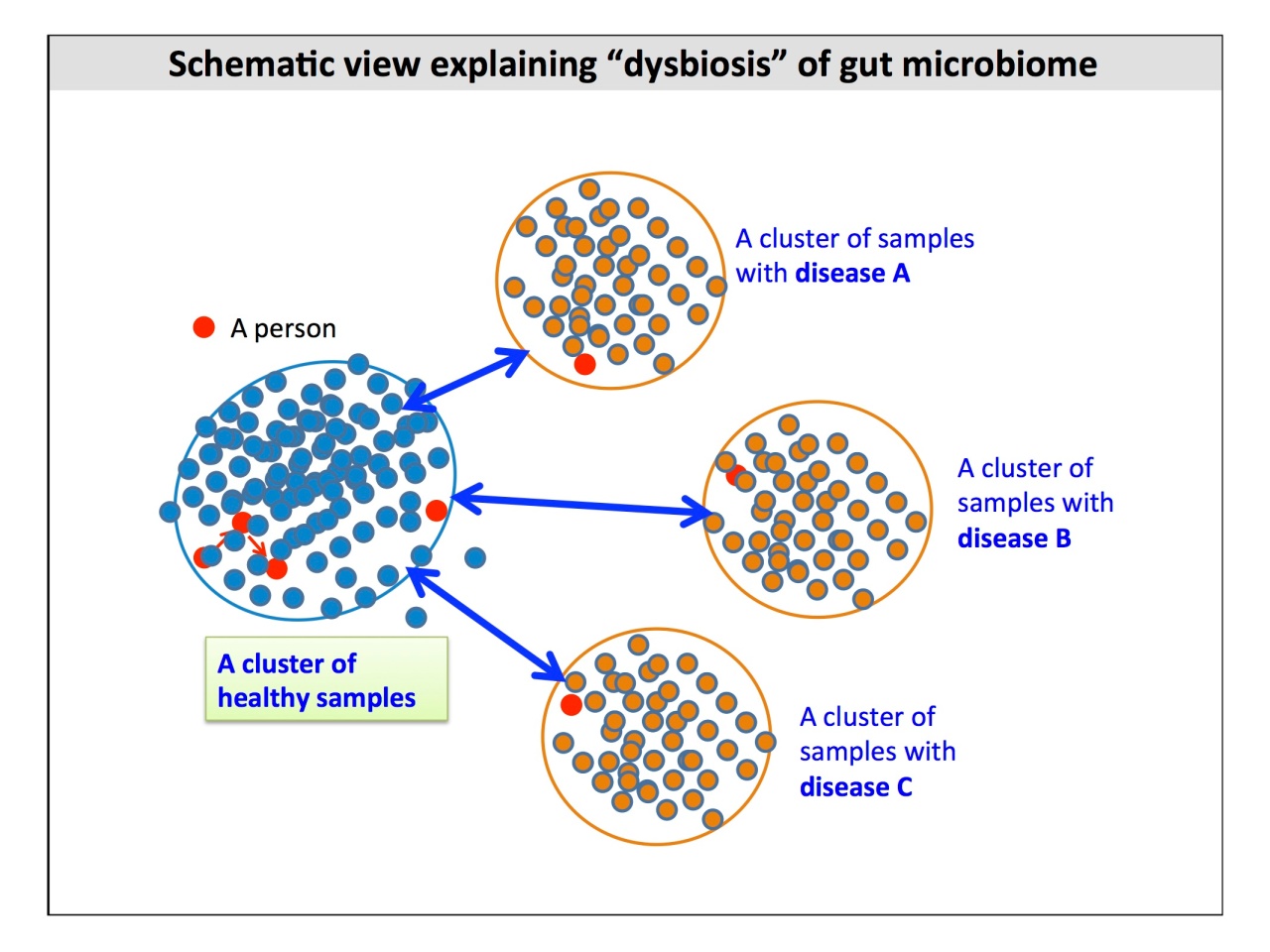
たとえば、国は異なるけれども同じ病気を持つヒト同士よりも、同じ国の健康と疾患の細菌叢の方が近いという結果が出ているそうです。
服部先生
「菌が病気を起こすのであれば、同じ二型糖尿病であれば国が違っても同じ菌が病気を起こさないとおかしいわけですよね。しかし、ほとんどオーバーラップがないし、病気が同じでも国ごとに菌叢は大きく違う。これは、まだまだカラクリが出て来ると思います」。
腸内細菌叢のなかに存在する唾液由来の細菌は、疾患でより多いこともわかっているそうです。唾液由来の細菌が腸内で何をしているのかを調べるため、無菌マウスに炎症性腸疾患(IBD)の唾液、健康の唾液を植菌したノトバイオートを飼育して定期的に便を採取して菌叢を分析。7週目には10〜20菌種ぐらいに減ったものの、マウスの腸管で安定的にコロナイズする唾液由来の菌が存在したという結果が示されました。
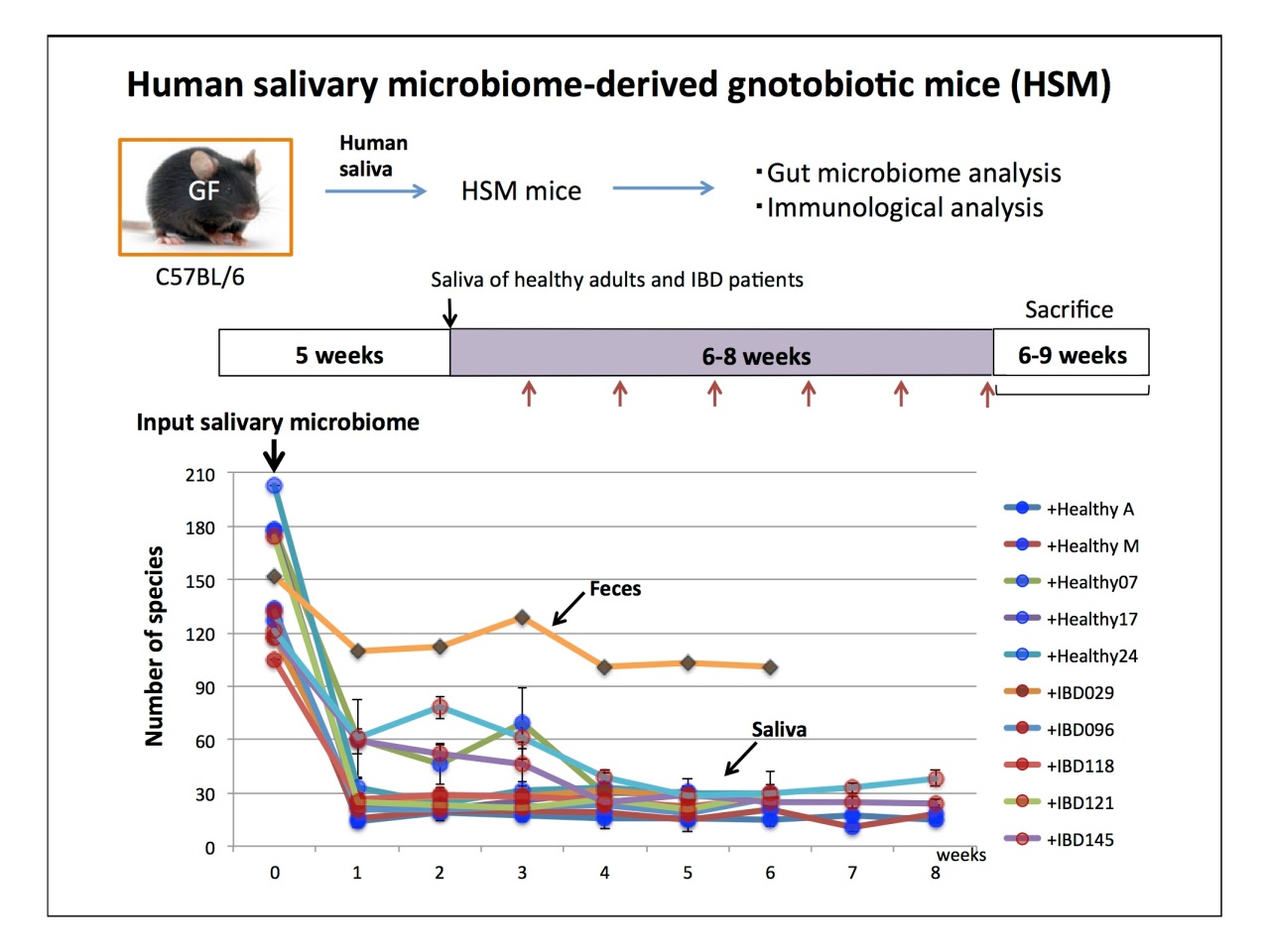
また、ノトバイオートをsacrificeして免疫を調べたところ、ガンマインターフェロンの誘導が見られたそうです。
服部先生
「KlebsiellaがいるとTH1が誘導されることがわかりました。そこで、無菌マウスに植菌してTH1の誘導の有無を調べると、KlebsiellaにもTH1を誘導するものとしないものがいるんです。ところが、無菌マウスにおいてTH1を誘導した菌は、SPFマウスにおいては何も起きなかったのですが、IL10-のSPFマウスに抗生物質を処理するとTH1誘導が起きて炎症を起こしました。炎症性腸疾患の可能性のひとつに、唾液のKlebsiellaが関与していると考えられます」。
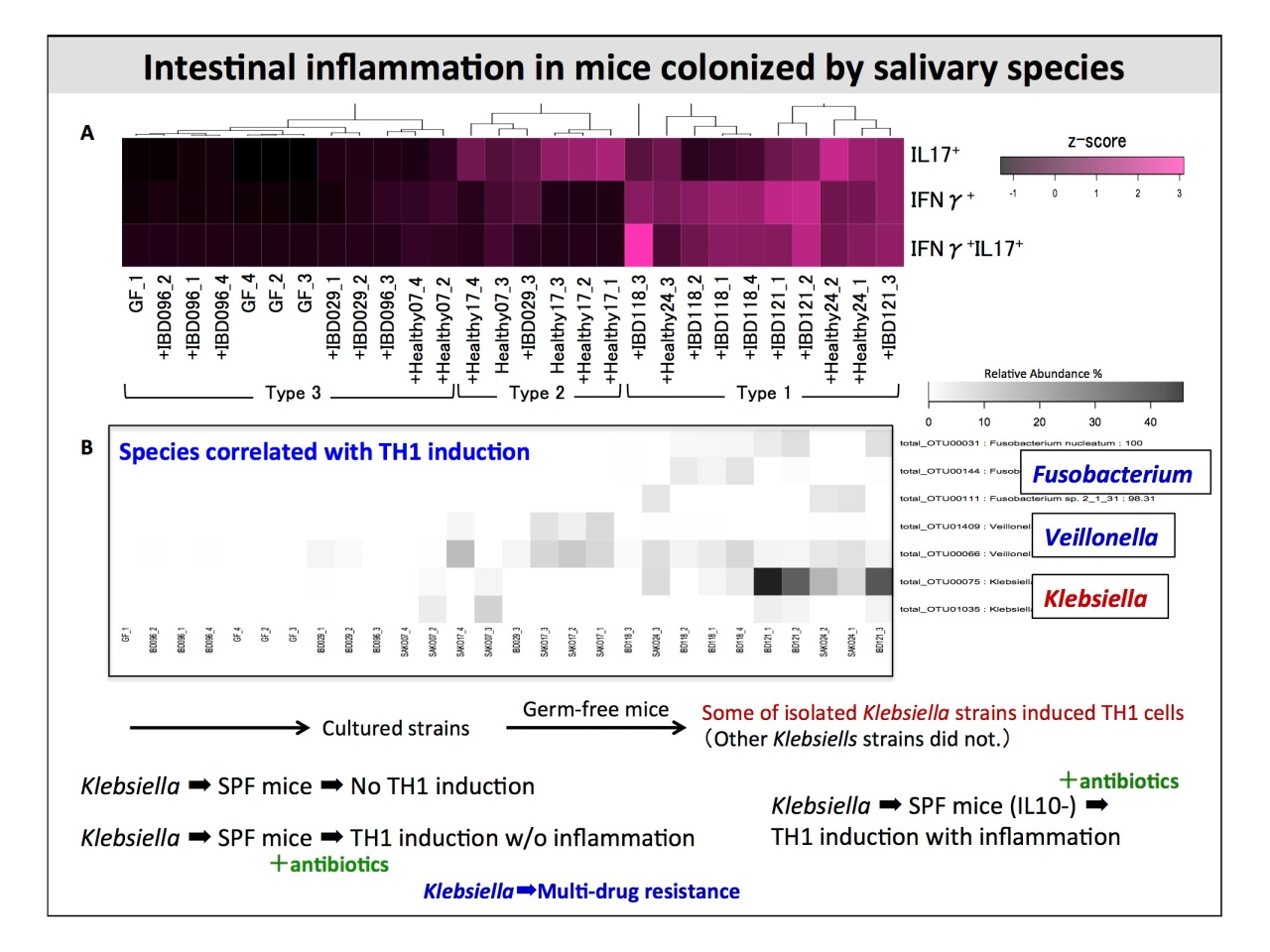
つまり、通常のSPFマウスの場合は、唾液細菌叢のKlebsiellaが腸管に入っても、ノーマルな腸管細菌叢があるので防御されます。ところが、抗生物質で処理するとノーマルな腸管細菌叢が壊れてしまい、結果的にTH1を誘導して炎症を起こしてしまうということがわかったそうです。
服部先生
「細菌、歯周病菌が腸管で悪さをすることが、全身の疾患に関連していると言われていました。ところが、歯周病になると歯科医は抗生物質で処理しますよね。それがノーマルな腸管細菌叢を悪くして、KlebsiellaなどがTH1や炎症を誘導しているのではないかと僕らは考えています」。
常在菌は単独ではフルに機能しない
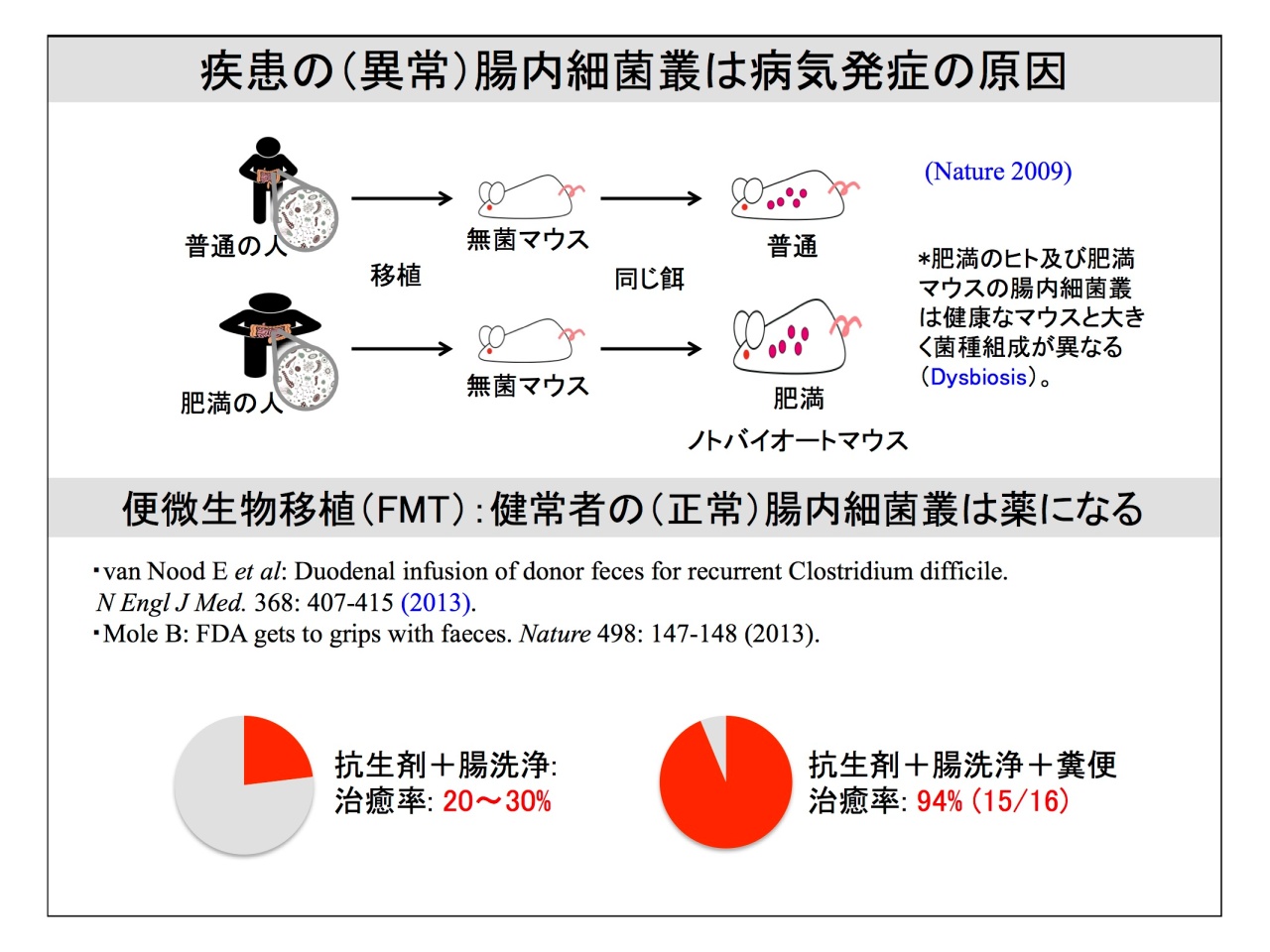
腸内細菌叢は疾患の原因にもなり、逆に健康な腸内細菌叢を便微生物移植(FMT)することで、治癒率が上がるというデータも示されました。
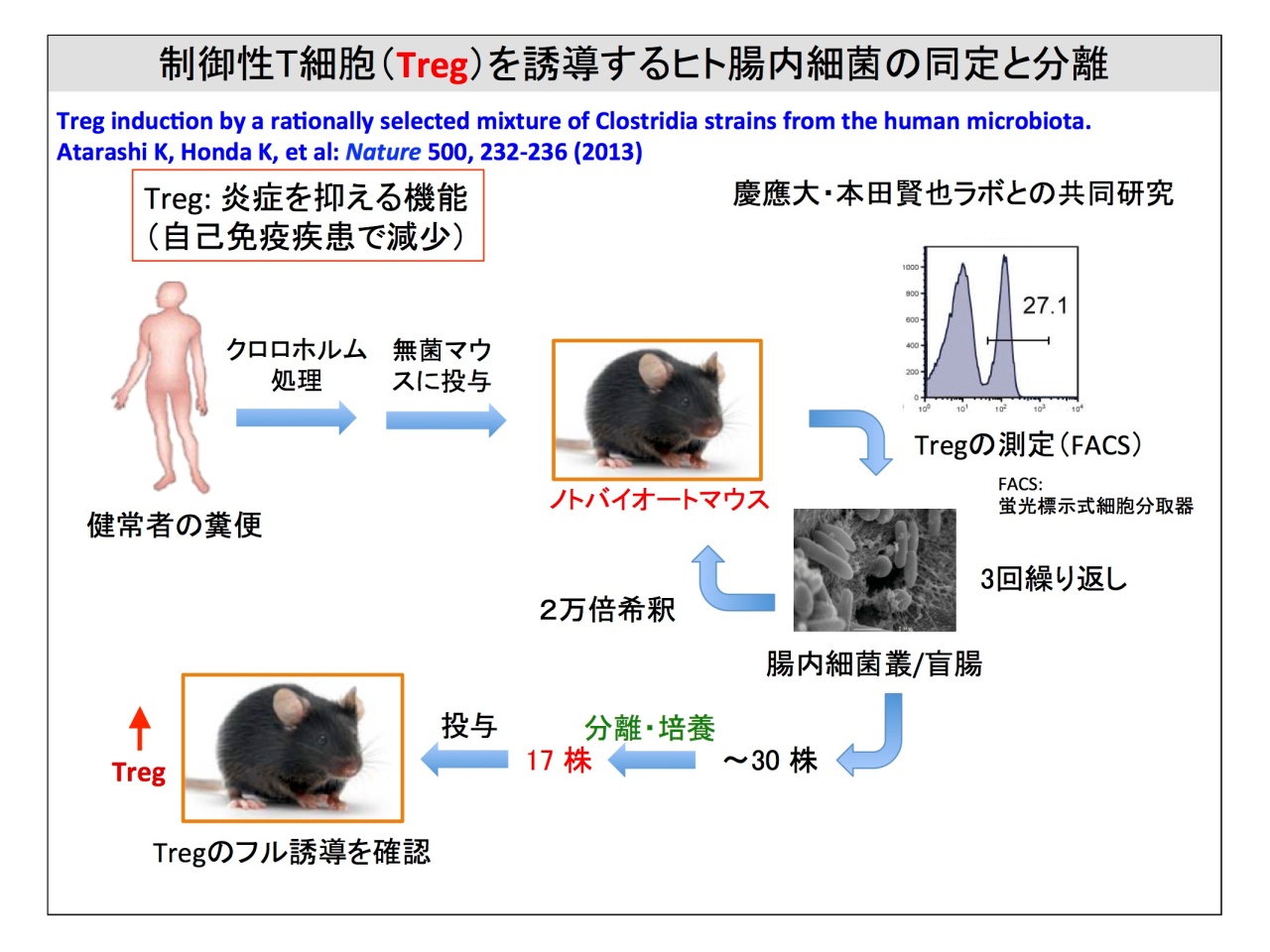
慶応義塾大学医学部微生物学・免疫学教室の本田賢也教授との共同研究では、腸内細菌叢から炎症を抑制する制御性T細胞(Treg)を結う誘導する細菌の同定と分離を行い、最終的に30株を特定。そのうち分離・培養できた17株をカクテルにして無菌マウスに投与すると、Tregのフル誘導が確認されたそうです。
服部先生
「17株から1株ずつ投与すると、驚いたことに1株だけではほとんどTregを誘導しませんでした。ランダムに3〜5株のカクテルをつくってもやはり17株のカクテルに比べると、誘導率は非常に低い。要するに、常在菌は単独ではフルに機能しないんです」。
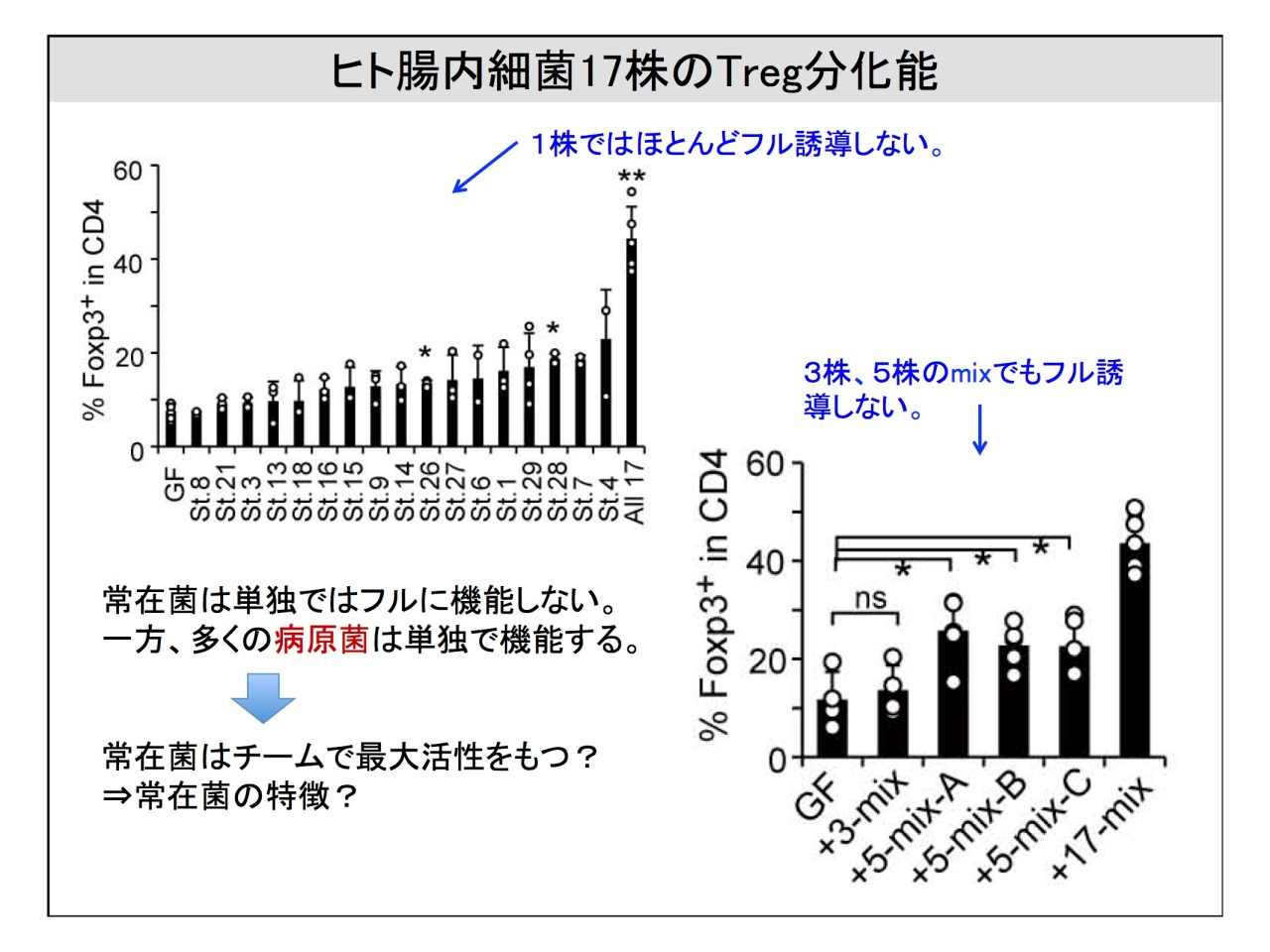
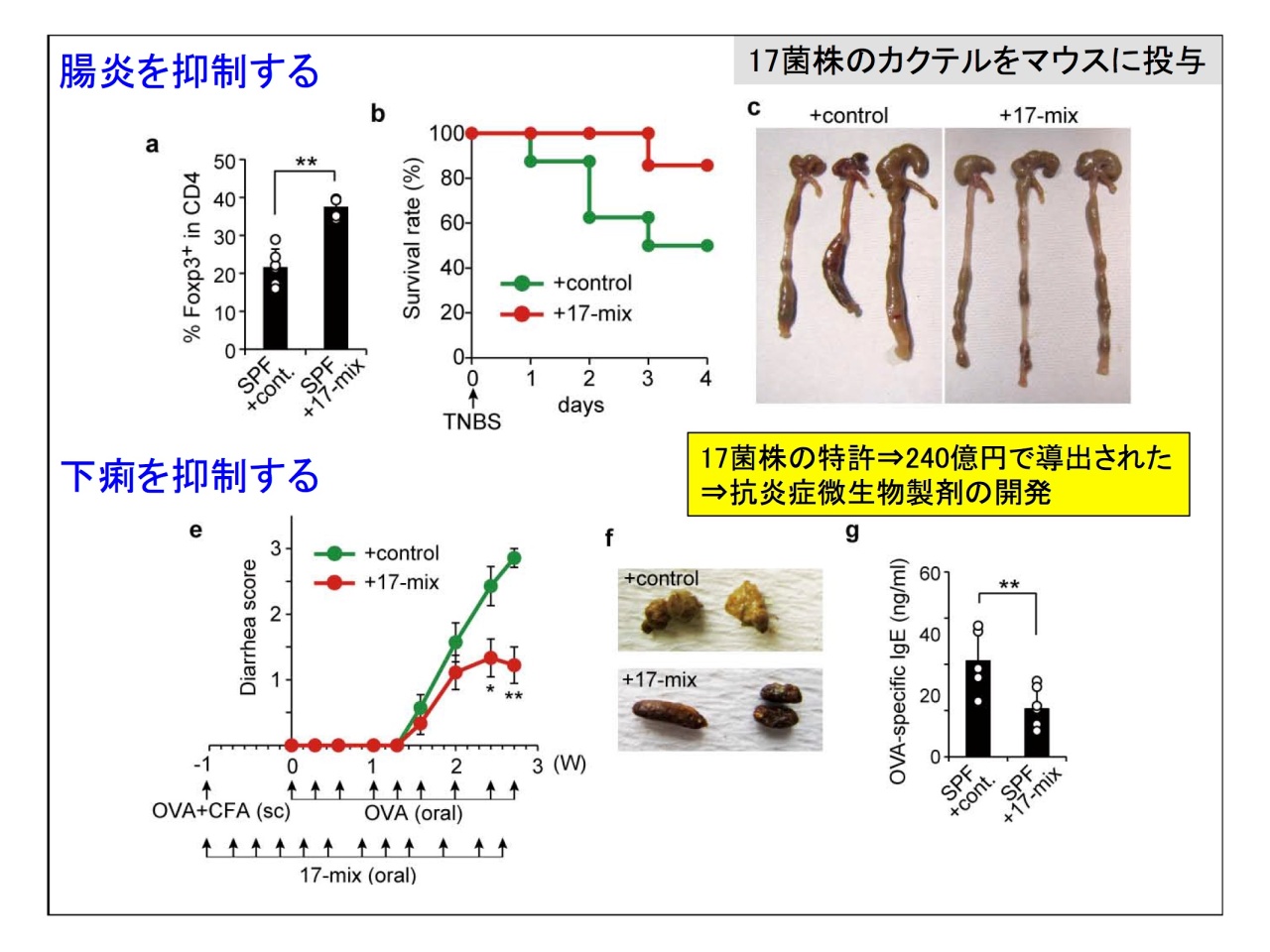
従来の細菌学では、1つの病原菌が疾患を起こすと考えられてきました。しかし、常在菌の場合は「ひとつの菌が何かを起こす」と考えるのは必ずしも正しいと言えないことになります。
服部先生
「ヒトに常在している菌ですから、一つの菌がすごい生理作用を持っていると大変なことになります。どうやら、常在菌はチームで最大活性を持つということがわかったというわけです」。
Tregを誘導する17株をゲノム解析すると、ほとんどがクロストリジウム系クラスターに属していたそうです。また、日本人患者と健康を対象に、17菌種の有無をデータで比較すると、IBD患者では15株が減少し、うち7株は有意に減少していたという結果が示されました。
ところが、炎症を抑制するTregを誘導する17株と、炎症を増長するTh17を誘導する20株(2015年に論文発表)は、うち6株がオーバーラップするというデータもあり、服部先生はその矛盾した結果の解明に意欲を見せておられました。

腸内細菌叢のタイプは薬の効き目にも影響する?
最後に、今後研究の進展が期待される領域として、PD-1抗体のレスポンダーとノンレスポンダーの腸内細菌の違いに関する研究が示されました。
服部先生
「明確に異なる腸内細菌叢を持つ、レスポンダーとノンレスポンダーに分かれるということは、ガンを抑える薬が効かない腸内細菌叢のタイプが関係しているということになります。今後は、薬の効き方について腸内細菌を見る必要が出て来る可能性も考えられます」。
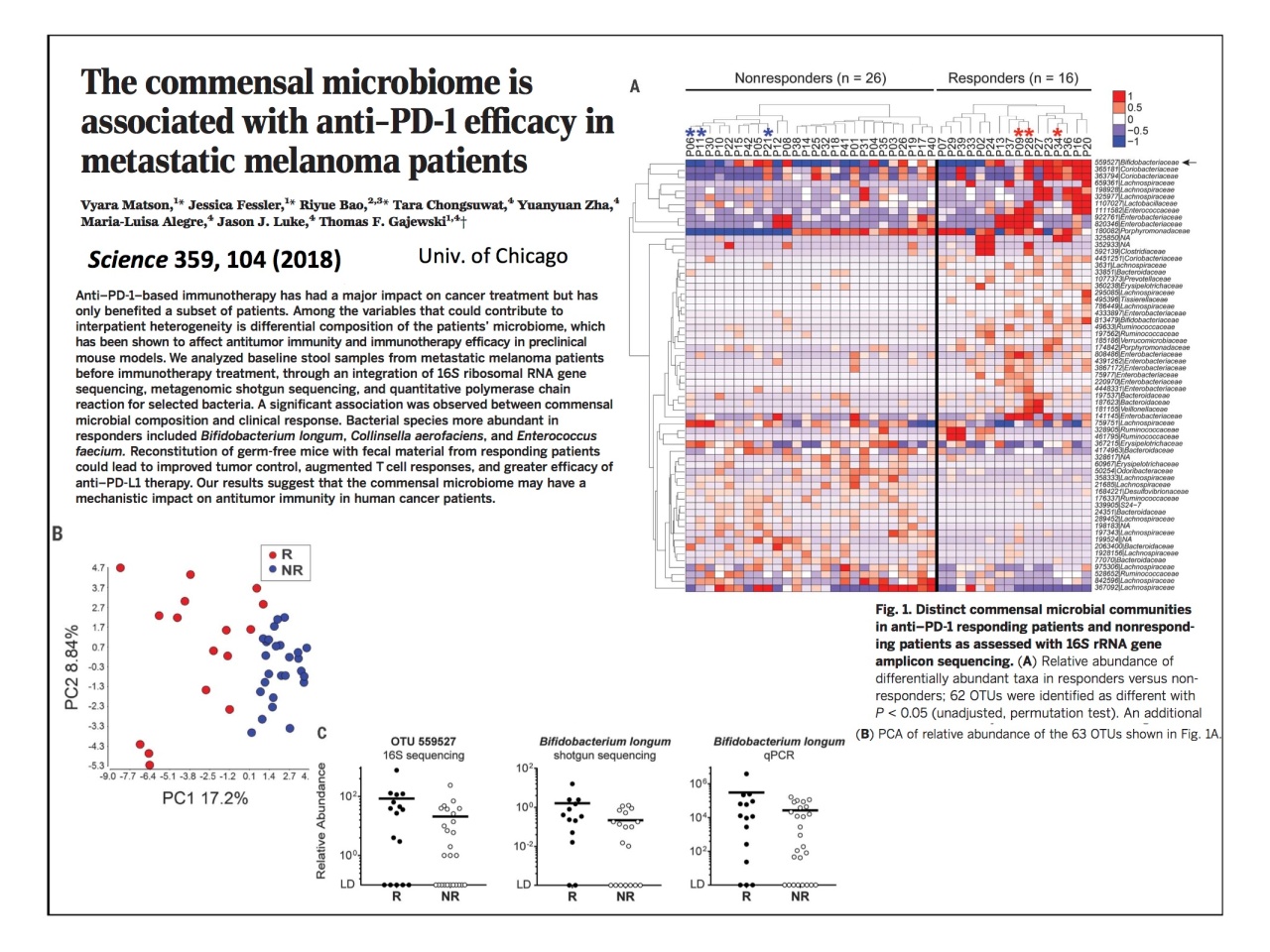
講演の終わりに、服部先生は「ヒトゲノムから細菌に移ったのではなく、ヒトに微生物がついているから、ヒトを理解するためにマイクロバイオームの研究をしている」と話されました。
服部先生
「今後は、個々の研究と並行して菌を分析する技術、ノトバイオートの技術を入れることでいろんなメカニズムを解明し、データを蓄積する必要があると思います。今は、薬がない病気に対してFMTを試みることも大事ではないでしょうか。FMTは基本的に副作用がないことが魅力的。FMT のデータと基礎研究のデータを合わせることで、マイクロバイオーム治療が日本や世界に根付くと考えます」。
今後の「たかつきモデル」との連携の期待
両講演ともに、さまざまな教室の先生方から活発な質問が行われ、細菌叢研究への関心の高さが伺われました。本シンポジウムの司会を務めた、口腔外科教室の植野高章教授は、シンガポールとの共同研究に着手していることから「2型糖尿病と歯周病の関係において、抗生物質がオーバーライトする」「細菌叢には国別の特徴がある」という点に関連して質疑応答に参加されていました。
また、服部先生の講演を司会した内科学II教室の樋口和秀教授は、「細菌叢の研究においてさまざまなデータが出て来ているなか、基礎と臨床のタイアップをどう実現するのかを考えてほしい」と語り、講演を締めくくられました。
今後は、大阪医科大学と他の研究機関が連携し、横断的な研究を展開することにより、「たかつきモデル」が学術的にもより意味深いものに発展することが期待されます。
登壇者プロフィール
須田亙先生
理化学研究所 生命医科学研究センター マイクロバイオーム研究チーム 副チームリーダー
千葉大学大学院園芸学研究科博士後期課程修了後、東京大学大学院新領域創成科学研究科特任研究員、慶應義塾大学医学部微生物学免疫学研究室講師を経て、2017年に理化学研究所生命医科学研究センター マイクロバイオーム研究チーム研究員、2018年から同チームの副チームリーダーに就任。服部正平先生とともに、メタゲノム解析による細菌の種類や組成の変動についての詳細な解析に大きく貢献。
服部 正平 先生
早稲田大学 理工学術院大学院先進理工学研究科 教授・東京大学名誉教授
大阪市立大学大学院工学研究科博士課程修了後、東亜合成(株)研究員、米国スクリプス研究所及びカルフォニア大学サンディエゴ校研究員、1991年東京大学医科学研究所ヒトゲノムセンター助教授、北里大学北里生命科学研究所教授、東京大学大学院新領域創成科学研究科教授等を経て、2015年に早稲田大学 理工学術院 先進理工学研究科教授に就任。2017年からは理化学研究所生命医科学研究センターチームリーダーを兼任。ヒト21番染色体の全解読などに大きく貢献後、メタゲノム解析という新しい手法により、世界に先駆けてヒト腸内フローラの全体像(マイクロバイオーム)を解明した。


