FUKUMORI AKIO
薬学部 薬物治療学Ⅱ研究室
教授

研究開発段階
研究のポイント
- Aβ蓄積開始から20年間の病態を評価するステージングバイオマーカー
- グリア細胞や神経変性関連分子断片を用いた非侵襲的診断法
- アルツハイマー病を超えた多様な神経疾患への応用可能性
研究キーワード
アミロイドβタンパク(Aβ)、アルツハイマー病(AD)、グリア細胞のAβ除去機構、バイオマーカー
研究の背景
アルツハイマー病(AD)に対する新薬レカネマブは、アミロイドβタンパク(Aβ)を標的とした抗体療法であり、Aβを除去することで治療効果を発揮する。このことから、AβはADの主要な病原物質であることが強く支持されている。しかしながら、Aβは産生された直後に臨床症状を引き起こすわけではない。ADの中核症状である認知機能障害は、Aβの脳内蓄積が始まってから約20年後に現れることが、ヒトの死後脳や画像研究により示されている。この間、Aβの蓄積に伴い、グリア細胞によるAβの分解・排泄といった除去機構の活性化や、その処理能力の破綻が生じる。これにより、シナプスの崩壊や神経細胞死などの病態変化が徐々に進行すると考えられるが、これらが起こるタイミングやカスケードの全貌は未解明のままである。これらを解明するには、脳内の変化を可視化する必要があるが、脳は閉鎖空間であり、重要な臓器であるため、直接的な観察が困難である。そこで、我々は膜貫通タンパクが放出する分子断片(約20~40アミノ酸)に着目している。これらの分子断片はサイズが小さく、髄液中のみならず血液中にも放出されている可能性があるため、脳内の病態を間接的に評価する有用な手段と考えられる。
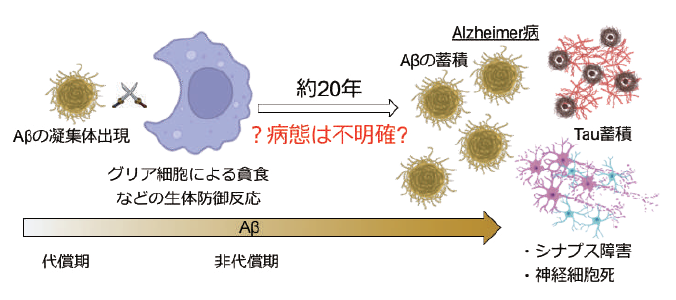
研究の概要・進行状況
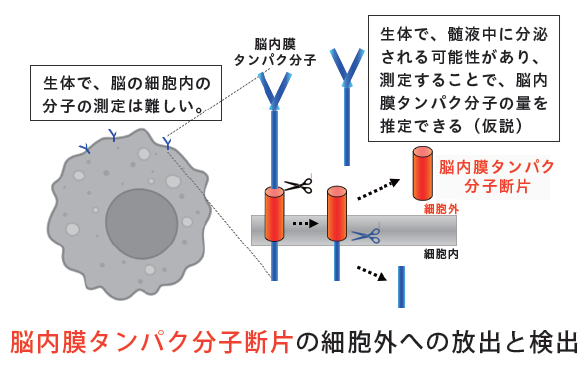
アルツハイマー病(AD)におけるアミロイドβ(Aβ)の脳内蓄積が進行する過程で生じる病態を解明するため、我々はAβの分解・排泄を担うグリア細胞や、AD脳で障害を受けるシナプスおよび神経細胞の膜貫通タンパクに注目している。これらのタンパクがプロテアーゼによる切断を受けて細胞外へ放出される分子断片をターゲットとし、その分泌機構の解明とバイオマーカーとしての有用性を検証している。
薬学部の学生と共同で、多様な膜貫通タンパクに関する研究を進めているが、ここでは特に、Aβの細胞内取り込みと分解を担う貪食システムに関与するTAM受容体に焦点を当てた研究を紹介する。TAM受容体は、プロテアーゼによる一次切断とγセクレターゼによる二次切断を経て、細胞外に断片として放出される。この断片を検出・測定することで、Aβ貪食活性や病態進行の指標となる可能性を検討している。
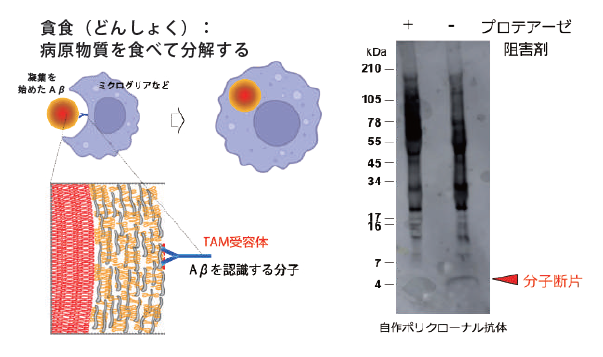
具体的な研究成果として、培養細胞を用いてTAMタンパクの切断を観察し、その断片を質量分析法で同定した。この解析から得られた切断部位の情報を基に、TAM受容体断片に対するウサギポリクローナル抗体を作製した。この抗体により、培養上清中に分泌されるTAM受容体断片を正確に検出することに成功している。
さらに、TAM受容体にはTyro3とAxlの2種類があり、これらに関する基礎データを薬学会で発表済みであり、論文投稿を準備中である。一部特許化もしている。現在は、TAM受容体断片に対するモノクローナル抗体の作製を進めており、最終的にはELISA法を構築して測定精度を高めることを目指している。特に、脳脊髄液や血液を用いた解析を通じ、これらの分子断片がAD病態の評価に本当に有用であるかどうかの検証を進めている。
市場性
TAM受容体断片を対象とした測定技術は、アルツハイマー病(AD)の病態を評価する新しい診断ツールとして市場価値を持っている。特に、髄液だけでなく血液中の分子断片を検出できる非侵襲的な検査として実用化されれば、患者負担を軽減しつつ診断の普及率を大幅に高めることが期待される。また、この技術は臨床試験における患者層の選別や治療効果の評価に活用可能であり、製薬業界にとって新薬開発の効率化や成功率の向上に寄与する。さらに、認知症関連の診断薬市場における高い競争力を持つ技術として位置づけられ、診断薬メーカーや医療機器メーカーにとっても重要な付加価値を提供する。
想定する社会実装の形
本技術は、髄液や血液を用いた診断薬キットとして実用化され、アルツハイマー病(AD)の治療効果モニタリングや治療開始時期の判断に活用されることを想定している。また、グリア細胞やシナプス機能の変化に関連する分子断片を測定することで、パーキンソン病、統合失調症、うつ病など、多様な神経精神疾患の診断や病態評価にも応用可能と考えている。非侵襲的な血液検査としての導入が進めば、医療現場での汎用性が向上し、特に地域医療機関での利用が期待される。また、モノクローナル抗体を用いた高精度なELISA法を開発することで、診断精度を高めるだけでなく、医療現場での効率的な運用を可能にする。これにより、神経精神疾患における包括的な診断ツールとして、医療の質を向上させることが期待される。
連携先へのメッセージ
中枢神経系の膜タンパク断片の測定技術は、製薬業界、診断薬メーカー、医療機器メーカーとの連携を通じて、多様な神経精神疾患の診断への寄与が期待できます。製薬業界では、アルツハイマー病(AD)をはじめ、神経炎症やシナプス障害を伴う疾患における新薬開発の効率化に貢献します。また、診断薬メーカーとの共同研究を通じて、血液を用いた簡便な診断ツールの実現が期待されます。さらに、高齢化が進む自治体においては、認知症やその他の神経疾患の早期診断や予防が急務です。本技術の地域医療機関への導入は、健康寿命の延伸や医療費削減に貢献する可能性があります。また、自治体主導の予防医療プログラムや住民啓発活動において、診断技術を活用することで、地域社会全体の健康意識を向上させる取り組みが進められるでしょう。本技術の社会的意義は、認知症だけでなく幅広い神経精神疾患の診断基盤を提供することにあります。産学官が協働することで、医療と福祉の持続可能な体制を構築し、高齢化社会における包括的な課題解決を目指します。
関連論文・知財
- アルツハイマー病の病原物質である凝集Aβを認識する受容体であるTyro3の代謝、髙嶋 結衣、柳田 寛太、新宮 愛、山口 敬子、岡田 健、福森 亮雄:27P2-pm1-071S、日本薬学会第143年会(札幌)、2023年3月
- ミクログリアがAβを認識し貪食する際に利用するタンパク質であるAXLのγセクレターゼによる切断、長谷 萌花、柳田 寛太、新宮 愛、山口 敬子、岡田 健、福森 亮雄:30P-pm454、日本薬学会第144年会(横浜)、2024年3月
- APLP2 is predominantly cleaved by β-secretase and γ-secretase in the human brain. Yanagida K, Maruyama R, Tagami S, Kudo T, Okochi M, and Fukumori A. Psychogeriatrics, 23(2), 311‒318, 2023
[特許]特開2024-099931