INTRODUCTION
「放射線治療」は、手術、抗がん剤に並ぶ「がんの三大療法」の一つ。1世紀あまりの歴史がありながら、今なお数々の研究開発が進められている。この記事では、その歴史とともに、大阪医科大学で展開されている放射線医学のトレンドにフォーカスしてみたい。
※文中の所属・職名は2018年3月現在のものです
より安全に、正確に。放射線治療100年の歩み
放射線治療のはじまりは、1895年にレントゲン博士がX線を、1898年にキューリー夫妻がラジウムを発見したときにさかのぼる。放射線によってがん細胞の遺伝子を壊しがん細胞を消滅させるため、臓器の機能や形を温存できるのが長所だ。
しかし、放射線はがん細胞だけを選択して照射することはできないため、治療の過程でどうしても正常細胞を傷つけてしまう。放射線治療の歴史は「正常細胞を傷つけずにがん細胞をやっつけるための技術革新がつくってきた」と放射線医学教室・吉田謙先生は話す。

吉田先生 100年前は弱いエネルギーのX線しかつくれなかったため、病巣近くに針で放射性物質を埋め込む「内部照射」が流行しました。その後、強い放射線をつくれるようになったため、体の外から病巣部を照射する「外部照射」が主流になります。現在、世界中で用いられているのがその進化形であるリニアック(Linear accelerator、直線加速器)という機器です。
リニアックは、体の深部にある病巣まで放射線を届かせることを可能にしたが、その通り道に当たる臓器にも影響を与えてしまう。そこで、多方向から病巣を狙う多門照射やがんの形に合わせて放射線を当てる原体照射が考案された。
2000年、日本にも臨床導入された「IMRT(Intensity Modulated Radiation Therapy、強度変調放射線治療)」は画期的だった。多方向から放射線量を変化させると同時に、CT(Computed Tomography、コンピューター断層撮影法)と同等の画像を確認しながら治療を行うことを可能にしたのだ。IMRTの導入により、正常細胞への影響は最小限に抑えられるとともに副作用も減少した。
吉田先生 外部照射にはもうひとつ、狙った病巣に対してぴったりと当てる「定位放射線治療」があります。以前は、患者さまを固定して治療していたのですが、近年では患者さまの動きを追尾する最新の装置も登場しています。
これからは、強度変調放射線治療と定位放射線治療の長所を合わせて、「四次元治療」の研究が進められていくという。
大阪医大で進む、臨床研究の最新トレンド
大阪医科大学で現在臨床研究が進んでいる放射線治療の中から、特徴的なテーマを4つ紹介しよう。
サイバーナイフ
定位照射の最先端となるのがサイバーナイフ。6つの関節を持つロボットアームに、小型化された放射線発生装置(直接加速器)が最大1200方向から放射線を照射。コンピューター監視により、患者さまの動きを追尾して治療を行える。大阪医科大学では、三島南病院にサイバーナイフセンターがある。
大阪医大式膀胱温存療法「OMC-regimen」
OMC-regimenは、抗がん剤の注入と膀胱局所への放射線治療を組み合わせた画期的な治療法だ。浸潤性膀胱がんでは根治的な全摘出が標準治療だが、膀胱は体にひとつしかない重要な臓器。ストーマ(人口膀胱)を設置すると患者さまのQOL(Quality Of Life)が著しく低下する。放射線増感作用のある高濃度シスプラチンとの相互作用により、極めて高い殺細胞効果を実現し、根治が望めない患者さまに可能性をもたらした。
増感剤を用いる「KORTUC療法」
KORTUC療法(Kochi Oxydol Radiation Therapy for Unresectable Carcinomas、酵素標的・増感放射線療法)は、増感剤を用いた放射線治療。放射線と酸素の力を借りてがん細胞を壊す治療法。増感剤を用いてがん組織に酸素を与え治療効果を向上する。酸素が欠乏しやすい再発がんなどでも、驚くほど効果が上がる症例も出ているという。
高線量率密封小線源治療
放射性金属イリジウム192を格納したカプセルを、病巣近くや内部に挿入して放射線を照射する治療法。リモートアフターローディングシステム(RALS)を用いて、遠隔操作で線源を送り出す。子宮、食道、気管支などに配置して照射する腔内照射と、病巣組織内やその近くに治療用アプリケータを刺入し照射する組織内照射が行われている。
吉田先生 外部照射は数週間をかけてゆっくりと治療を進めますが、小線源治療は1週間で高線量を当てます。がんが毎日どんどん縮んでいくのですごくうれしいですね。
前立腺がんや子宮がんに対する組織内照射のネックは、股の部分にステンレス針を刺すため、治療期間中は身動きが取れず足腰が弱ってしまうことだった。そこで、吉田先生が考案したのはプラスティック針への切り替えだ。
吉田先生 針を刺すための金属製のテンプレートをなくし、超音波検査をしながらフリーハンドで精密にプラスティック針を刺すことにより、患者さまに翌日から歩いてもらえるようになりました。プラスティッック針ならMRIも可能ですから、CTの結果と重ね合わせて正確な病巣位置がわかる。副作用が減りましたし、7〜8年経過後にも良好な成績が得られています。
特に子宮がんにおいて、「患者の翌日歩行」が可能になったとする論文は世界初。「ステージ3の子宮がんでも、3年後の経過で90%治っていた」という結果も出た。今後の経過次第では、世界のトップランナーとして認められる可能性も大きい。
***
さらにもう一つ、大阪医科大学では、日本が世界に先駆けて研究・開発を進めているBNCT(Boron Neutron Capture Therapy、ホウ素中性子捕捉療法)がある。ここからは、BCNT研究を推進してきた、脳神経外科学教室の黒岩敏彦先生と、がんセンターの宮武伸一先生にご登場いただこう。
症例数は世界一。大阪医科大学のBNCTへの取り組み
BNCTの特長は、「がん細胞と正常細胞を区別し、がん細胞だけを選んで死滅させる」こと。がん細胞だけに選択的に集積するホウ素薬剤を投与した後、中性子を照射する。

黒岩先生 中性子を当てても、ホウ素薬剤を投与しても、人体にはほぼ影響はありません。しかし、ホウ素を取り込んだがん細胞に中性子が当たると、核反応が起きてがん細胞が死滅します。
適応が期待されるのは、正常細胞の間にがん細胞が存在する浸潤性の腫瘍や、臓器全体に広がったがん、転移性・難治性のがんなど。また、BNCTは通常の放射線治療を行った後のがんでも治療できるという長所もある。
宮武先生 ただし、BNCTを適応できるのは、がん細胞がホウ素を取り込む患者さまだけです。治療の可否は、ホウ素薬剤のがん細胞への集積を「PET検査」で確認し、適応可能かどうかを調べてから判明します。
大阪医科大学では、20年以上に渡ってBNCTによる脳腫瘍治療の臨床研究を重ねて来た。現在、データに残された症例だけでも170以上。世界一の症例数を誇る。
「失敗で諦めない姿勢」がBNCTの可能性を拓いた

アメリカの物理学者LocherがBNCTのコンセプトを発表したのは1936年。脳腫瘍に対するBNCTの臨床研究が進められたが、治療後に放射線壊死を起こした脳の腫れを「再発の可能性あり」とみなしたアメリカの研究者たちはBNCTを断念した。
しかし、日本の研究者たちは諦めずに、中性子ビームとホウ素化合物の改良を重ねた。失敗を失敗として終らせず、その原因をていねいに追求し続けついに突破口を開いた。
宮武先生 私たちは脳の腫れを調べるために患者さまの許可を得て手術を行い、脳の状態を顕微鏡で詳しく調べました。すると、生きた腫瘍細胞はなく、再発は認められなかった。脳の腫れの原因は、放射線で傷んだ脳が血管を作ろうとした結果だったとわかったのです。
宮武先生がBNCTの治療効果に確かな手応えを感じたのは20年前。大阪医科大学に着任してはじめて、熱外中性子を用いたBNCTを行ったときだった。
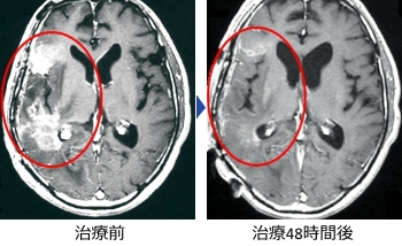
黒岩先生 熱中性子を用いていたときは、開頭手術をして腫瘍部分に直接当てる必要がありました。原子炉の傍で、治療の前後に手術をするのは本当に大変でしたね。ところが、熱外中性子は、深部まで届くから開頭手術が不要になりました。
宮武先生 熱中性子でのBNCTでは思うような治療効果が得られていませんでした。しかし、熱外中性子は驚くほど効いた。はじめて、熱外中性子を用いたとき、先にMRIをご覧になった黒岩先生が「こんなに効くんですか」とおっしゃったのですが、私はMRIを見もしないで「そんなに効きませんよ!」と返答したのを今も覚えています。
MRIには、腫瘍が劇的に消失している脳が写っていた。「BNCTを治療法として確立させなければいけない」と、ふたりの決意が決まったのもこのときである。

世界最先端の研究の場をつくる
現在は、膠芽腫(こうがしゅ=脳腫瘍の一種)を対象とした臨床研究が進んでいる。すでに、生存期間の中央値は倍以上、再発患者においても2〜3倍という、非常に良い結果が得られているという。
黒岩先生 今まで、どうしようもなかった悪性の膠芽腫において良好な成績が出ていますので、BNCTの適応を他のがんにも広げていきたい。「『がん』といえば大阪医科大学」というブランドを目指したいですね。
今後の大きな課題は、保険適用を実現し、BNCTを受けられる患者さまを増やすこと。そのためには、これまでの標準的な治療よりも、BNCTが優れていることを科学的に実証しなければならない。同時に、より安定したホウ素化合物やBNCT用加速器の開発も待たれる。
そんななか、2018年には大阪医科大学を中核として「関西BNCT共同医療センター」が設立される。関西に集積する、大阪医科大学を始めとした放射線治療の研究拠点の研究者たちと、データや治験を共有しあうことで、放射線によるがん治療の拠点となることが期待されている。
黒岩先生 ホウ素化合物は大阪府立大学がメインで開発し、より均一な状態での大量生産を目指しています。住友重機械工業が、世界初となる小型のBNCT用加速器(サイクロトン)の開発に成功。京都大学原子力実験所での臨床試験、福島県の総合南東北病院での治験も始まっています。関西BNCT共同医療センターにも、この加速器が導入される予定です。
宮武先生 BNCTはまったく新しい領域ですから、これから活躍してくれる若い人をどんどん育てなければいけません。放射線医師をはじめとする医療スタッフを育てるのも、大阪医科大学の重要な役割だと思っています。
やってみないとわからない。放射線治療医の“面白さ”
イノベーションが繰り返される領域であるがゆえに、放射線治療医にはパソコンに向かうデスクワークも多い。たとえば、IMRT前の治療計画の作成。患者さまの負担が少なく、最も効果的な照射を可能にする位置決めには、緻密な検討が重ねられている。
しかし、単調な仕事が多いのかというと決してそうではない。治療において放射線治療医は、意外なほど幅広い役割を持っている。たとえば、“主治医”にならないからこそ可能になる外来診療もそのひとつだ。

吉田先生 主治医の先生がやさしすぎて、患者さまが「まだ何年も生きられる」と誤解しているときは、「あなたは来年の桜を見られない可能性がないわけではないんだよ」とそっと伝える。あるいは、泣きながら放射線科に来る患者さまには笑顔になってもらう言葉をかける。主治医とのバランスをとりながら外来をやれるのは、放射線治療医ならではの面白さだと思います。
また、その治療によって実現できることの幅広さも放射線治療の魅力である。
吉田先生 目に見えない光を当てるだけで、がんが消えていくのを確認できるのは、放射線治療ならではの魅力だと思います。根治的な治療も緩和的な治療もできるし、小線源治療のように手術的な治療もできますから。
「放射線治療」の面白さは、充実したハードウェア(施設)を有する環境でこそ深められる。大阪医科大学には、最新の設備とともに、放射線治療の歴史をつくり、また世界で最も新しい治療法の未来を拓こうとする先生方が待っている。