ASAI AKIRA
中央検査部 部長/特別職務担当教員(准教授)
医学部 内科学Ⅱ教室 兼担

研究開発段階
研究のポイント
- 肝臓に存在するKupffer細胞は、 肝硬変において特異的な活性型をとる
- 肝硬変宿主のKupffer細胞は肝線維消失を目的とした遺伝子治療の対象となる
- Drug delivery systemの考慮により核酸の輸送効率や安定性が改善し、治療効果向上が見込める
研究キーワード
肝硬変、 Kupffer細胞、 遺伝子治療、
CCL 1 antisense oligodeoxynucleotides (CCL 1 AS ODN)、 Drug delivery system (DDS)
研究の背景
慢性肝疾患の終末像として位置づけられる肝硬変は、肝炎ウイルス感染、アルコール摂取、自己免疫疾患、非アルコール性脂肪 性肝炎など、様々な病因が引き金となって進行する。これらの病因によって肝細胞が慢性的な炎症により破壊再生を繰り返すことにより、肝臓内では再生結節が形成され、その周囲を線維化した組織が囲むことで硬くなり、肝硬変に至る。肝硬変において は肝線維化の進展による門脈圧冗進症が特徴的に見られる。門脈圧の冗進は、肝内外に様々な合併症を引き起こすことが知られ ており、それらは肝硬変患者の主な死因となっている。現在、肝硬変患者は世界中で約2,000万人にのぼるとされ、肝硬変の年 間の総死亡者数は約80万人に達すると報告されている。肝硬変の根幹的な病態は「肝線維化」であるが、一度形成された肝線維は不可逆的であり、現時点では完全に元の正常な肝組織へと戻す方法は存在しないとされている。その為、これまでの肝硬変の 治療アプロ ー チは原因疾患に対するものが主流となっているが、それはウイルス性肝炎といった一部の原因疾患に対する治療に おいては目覚ましい進歩を遂げている一方、その他のアルコール、非アルコール性脂肪性肝炎、自己免疫疾患等の肝線維化が鍵となる疾患に対する効果的な治療は未だ存在していない。その為、近年では、肝硬変患者に共通する「肝線維の消失」を治療夕ーゲットにすることが強く求められている。しかし、線維組織に対する治療の多くは線維の中心物質であるコラ ーゲンに対するもので、コラ ーゲンは体内に最も農富に存在している蛋白質で、組織や臓器の形態保持のみならず創傷治癒や組織の修復過程に も関与している為、その阻害は他臓器や全身に影響し様々な副作用を起こすことから、タ ーゲットとすることが困難となってい る。また、コラ ーゲンを作り出す星細胞もしくは筋線維芽細胞に対してのアプロ ーチも同様に、肝臓に存在する細胞のみを対象 にすることができず様々な臓器に分布している筋線維芽細胞にも影響して副作用を引き起こしてしまう為、創薬に至っていない。現在のところ、臨床で使用可能な線維化改善療法は世界的に見ても存在せず、この分野での治療開発が急務となっている。
研究の概要・進行状況
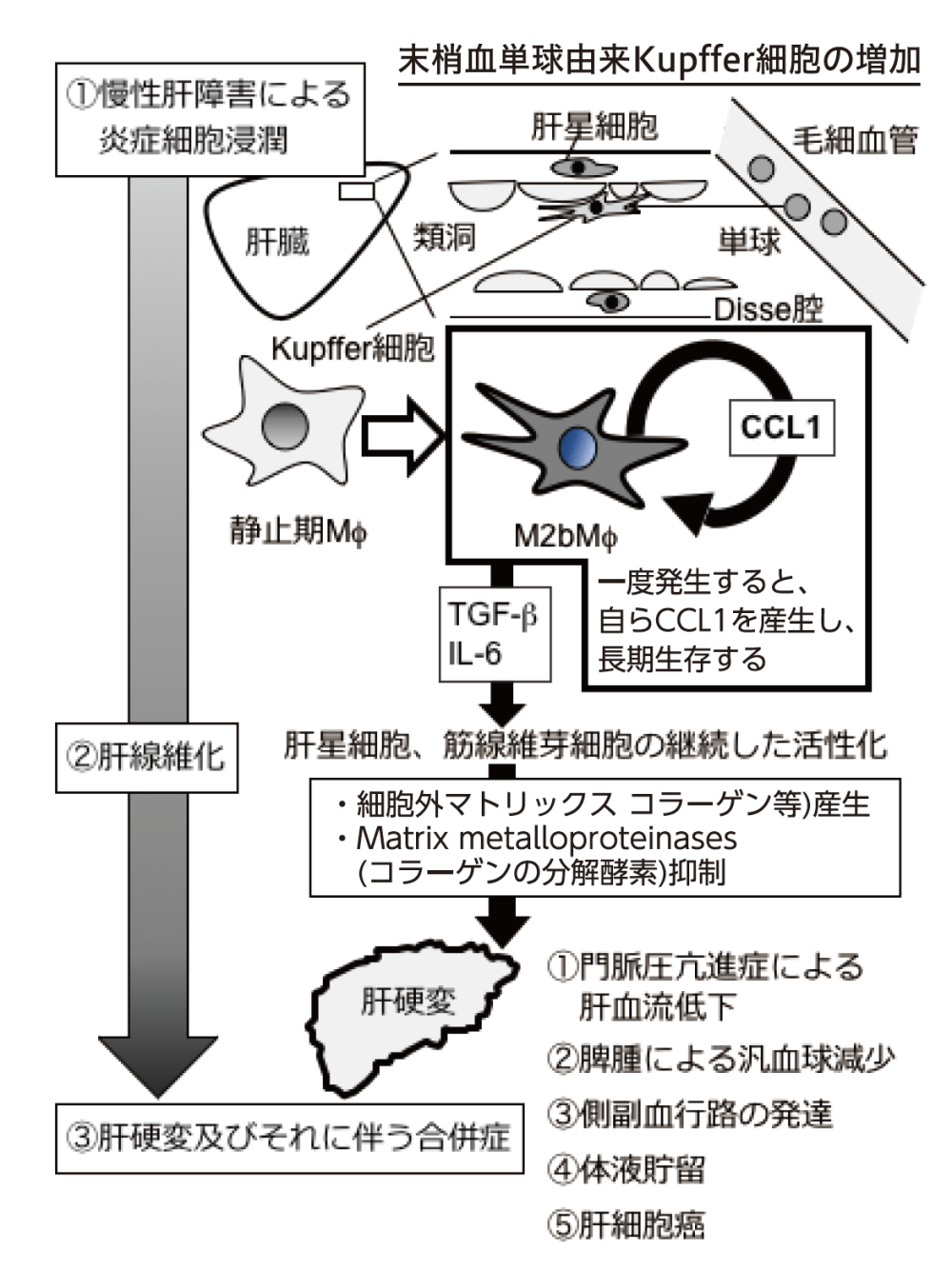
我々は肝臓に特異的に存在するM¢であるKupffer細胞に着目し、肝線維化を予防のみならず消失させる新規遺伝子治療を開発す ることを目指し研究を行っている。活性化したM<Pのうち、M2aM</)やM2cM</)は短期間でその性質が消失する一方、M2bM</)は長期に渡って存在することが明らかになってきた。
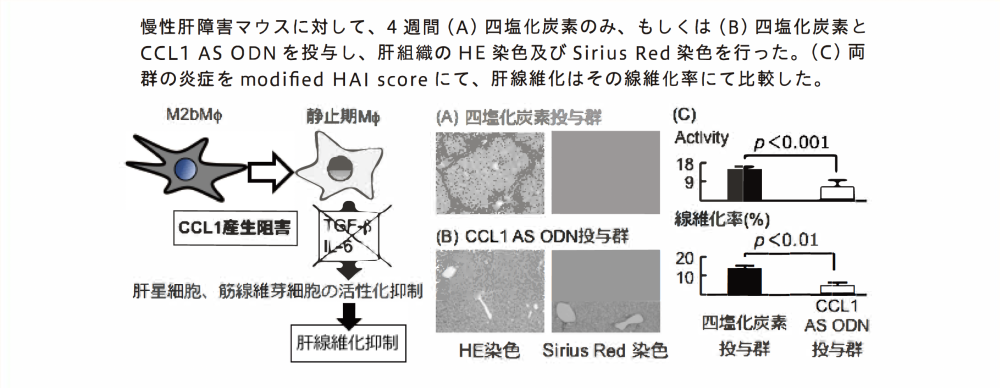
我々は先行研究により、慢性炎症を起こした肝臓に存在するほとんどの活性化したKupffer細胞は炎症に応じて反応性に浸潤した末梢血単球由来Kupffer細胞であり、それらはM2bM</)の性質を持つことを明らかにしてきた。さらに、活性化したM2bM</)から分泌されるケモカインの一種であるCCL1に注目し、このCCL1がM2bM</J自らの生存を延長させることも明らかにした。続いて、M2bMののCCL1産生能をCCL1 AS ODNを用いた遺伝子療法で修飾すれば、静止期M¢に先祖帰りさせることによりM2bM</)が激減し、局所に分布する多くのM¢と合わせて、その活性化を抑制させることを明らかにしたU.Leukoc.B iol. 2012; 92: 859-67)。それらの先行研究から、慢性肝障害マウスではM2bM</)が長期に存在し肝 静止期Mt星細胞や筋線維芽細胞を活性化させ続けることで肝線維化を強力に促進させてしまうのではないか、さらにCCL1 AS ODNにより遺伝子治療を行うことで肝線維化を改善できるのではないかと仮説を立てた(図1)。実際に、肝硬変マウスに対して遺伝子治療を試みたところ、新たに生じる肝線維抑制が認められた(図2)。現在、核酸の対象細胞への輸送効率及び安定性の向上の為、CCL1 AS ODNを搭載したDru delivery systemを検討し、毒性評価や効果向上を検討している。
今までの治療法、治療薬は、肝療法ではなく、主な構成物質であるコラーゲンや、それを産生する細胞をターゲットとしており、他臓器や全身に下痢や皮膚疾患といった様々な副作用を及ぼしてしまうという問題があり、開発に至っていない。この肝繊維を消失させる治療法は今までにない肝硬変の根本的治療を実現し、本研究はその一助となると期待している。
市場性
予備実験では、既に存在する肝線維を消失させる治療効果のみならず、新たに生じる肝線維化の予防効果も認められており、世界中に存在する2,000万人に対する肝硬変患者のみを対象とするだけでなく、自己免疫性肝炎(80万人)、アルコール性肝疾患患者(100万人)、さらには非アルコール性脂肪性肝炎(おおよそ4億人)等の効果的な個別治療が存在せず肝線維化進展が鍵となる疾患に対しても、新規治療対象となり得る可能性がある。この治療の学術的メリットは、肝線維化合併症である肝癌や非代償性肝硬変の進行が抑制できることにある。それは肝移植や肝切除、抗がん治療等の治療抑制が可能となり、患者の就労や生活の質の
維持といった社会的メリットのみならず、治療費の大幅削減が予想され、それは日本とアメリカだけでも年間数十億ドル医療費削減という大規模な経済的なメリットにも繋がる。
想定する社会実装の形
線維化治療メカニズムの解明により、肝移植を回避する可能性を提供し、大きな医療費削減や臓器不足問題の解決を目指す。本研究のDDSはCCL1 AS ODNのみならず他の治療薬にも応用可能であり、核酸医薬品分野の発展を促進し、新たな市場ニーズの創出に繋がることを期待している。また、Kupffer細胞の活性型を変化させる技術からは、新規バイオマーカーの開発を想定し、疾患診断や治療効果モニタリングの新たな道筋としての可能性を想定している。
M2bM</>という特殊な免疫細胞の性質を変化させ免疫環境を修飾する戦略は、がん免疫療法や自己免疫疾患の治療開発にも応用可能であり、肝線維化改善のメカニズムの分子レベルでの解明は、その他の線維化疾患(特発性肺線維症、拡張障害型心不全や腎線維症等)に対する新規治療法の開発の促進が狙える。肝硬変と同様にM2bM</>関与が判明している疾患であるSLEや熱傷の疾患制御においても本治療法が展開可能だと期待している。
連携先へのメッセージ
社会実装に向けた研究を推進する為、創薬について知識や経験を持つ研究者や企業との共同研究を求めています。
特に臨床研究への橋渡しを行う知識やスキームを持つ企業を希望します。
関連論文・知財
- CCL 1 released from M2b macrophages is essentially required for the maintenance of their properties. Asai A, Nakamura N,Kobayashi M, Herndon DN, Suzuki F.J Leukoc Biol, 92(4), 859-67, 2012
- Drug Delivery with Hyaluronic Acid-Coated Polymeric Micelles in Liver Fibrosis Therapy. Yoshizaki Y, Yamasaki M, Nagata T,Suzuki K, Yamada R, Kato T, Murase N, Kuzuya A, Asai A, Higuchi K, Kaji K, Yoshiji H, Ohya Y. ACS Biomater Sci Eng, 9(6),3414-3424, 2023
- Host antitumor resistance improved by the macrophage polarization in a chimera model of patients with HCC. Asai A,Tsuchimoto Y, Ohama H, Fukunishi S, Tsuda Y, Kobayashi M, Higuchi K, Suzuki F. Oncoimmunology, 6(4), el 299301, 2017
[特許]PCT/JP2024/002979