INTRODUCTION
飲んだ薬の何パーセントが使われているのか

薬を飲むと、確かに何らかの効果がある。では、口から取り込まれた薬は、どのようにして効果を発揮しているのだろうか。飲んだ薬は胃腸で溶かされた後に小腸で吸収され、目的とする部位にまで届けられて効果を発揮する。腸壁から吸収されるためには、薬効成分が分子レベルで溶けている必要がある。
「しかも溶けていても、飲んだ薬がすべて吸収されるわけではありません。たとえば鎮痛薬としてよく使われるインドメタシンを例に試験菅内でイメージしてみます。その溶解度、つまり水に溶ける量は、体温の37℃ぐらいなら水1mLに対してわずかに5μg(マイクログラム=1/1,000,000g)に過ぎません。仮にインドメタシンの錠剤が1粒25mgだとすれば、これを全部溶かすためには水を5L飲む必要があります。コップ1杯つまり200mLぐらいの水と一緒に飲んだぐらいでは、まったく溶けていません。逆にいえばコップ1杯の水で溶けるぐらいの量、つまり計算上は1mg程度の吸収量で、痛み止めの効果を発揮できるようにつくられているのです。」
実際インドメタシンに限らず多くの薬は、その大部分が体外に排出される前提でつくられている。だとすれば、より溶けやすくすれば、飲む薬の量を減らせるようになる。戸塚教授が研究としている製剤設計のテーマの1つは溶けやすさの追究である。すなわち薬効成分の分子をより溶けやすくして、より多く体内に取り込む。そのためにはどうすればよいか。
薬効成分のまわりを添加剤で包み込む
ウコンと呼ばれる生薬がある。カレーの香辛料としても使われ、その有効成分のクルクミンには、肝機能強化や抗炎症などの作用があるとされる。ただしクルクミンも水に溶けにくく、溶解度は0.3μg/mL(37℃)に過ぎない。だから30mgのクルクミンを全部溶かすためには100Lもの水が必要になる。
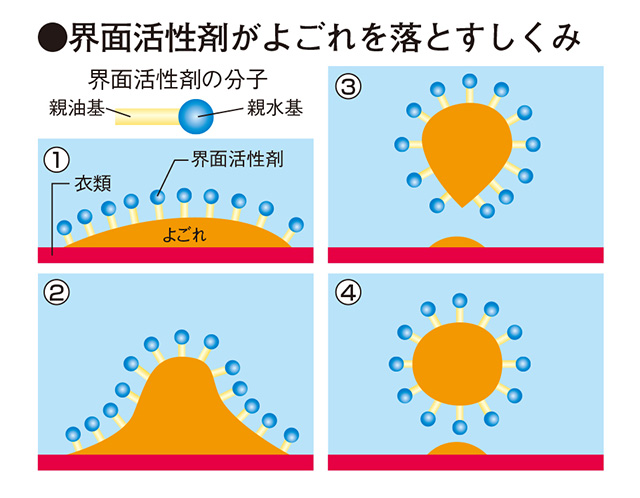
「疎水性のクルクミンを水に溶かすためには、どうすればよいか。思いついたアイデアが、界面活性剤の分子の集合体であるミセルの応用です。洗剤で水中の油よごれを落とすときには、界面活性剤がよごれを包み込んで水に溶かします。具体的には、界面活性剤の親油基が油よごれにくっついて、親水基を水に向けるようにしてよごれを包み込む。だから包み込まれたよごれが、あたかも水に溶けたような状態で運ばれていく。このメカニズムをクルクミンにも応用するのです。もっとも洗剤として使われる界面活性剤は、人に対して毒性を持つため使えません。だから研究テーマは、他の成分を使った界面活性剤と同じ構造の実現となります」
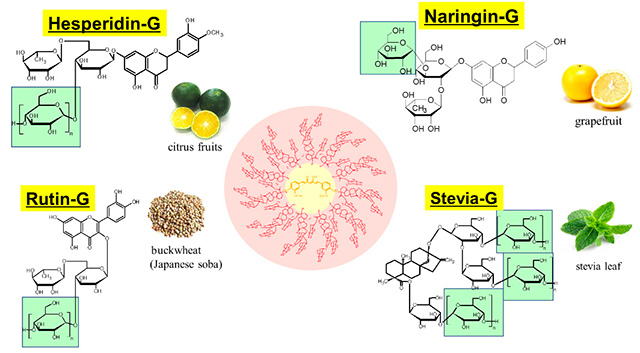
戸塚教授らのグループは、界面活性剤のようにクルクミンを包み込む添加剤を探索していった。ただし、人体に無害であるのが絶対条件となる。その結果、酵素処理ヘスぺリジン(Hesperidin-G)、酵素処理ルチン(Rutin-G)、酵素処理ナリンジン(Naringin-G)、酵素処理ステビア(Stevia-G)などの機能性添加剤が見つかった。
「ヘスぺリジンはみかんの皮(柑橘類)、ルチンはそばの実、ナリンジンはグレープフルーツ、ステビアは甘味料としても使われる植物、いずれもその抽出成分を加工して使います。これらでクルクミンを包み込んだ結果、水に溶けたような構造体を作り出せました。その結果、人体への吸収性も高められています」
抽出成分の加工に際しては、ナノレベルでの構造設計が施されていて、その成果は特許も取得済みだ。一連の研究の応用として、教授たちが今取り組んでいるのが漢方薬で使われる甘草の活用である。漢方薬も水に溶けにくい生薬の塊だが、甘草を混ぜると溶けやすくなる。そこで甘草が働くメカニズムを分子レベルで解明し、新たな添加剤としての活用を考えている。

吸い込んだ薬は、肺の中でどうなるのか
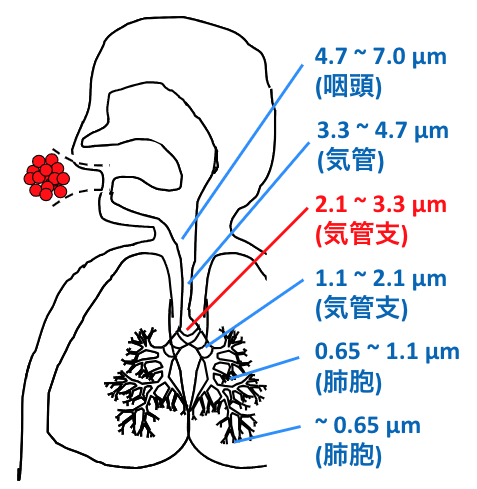
戸塚教授らが取り組んでいる、もう一つのテーマが吸入薬である。息を吸い込んで体内に取り込む薬は、肺の中でどれぐらい奥深くまで到達しているのか。この課題を解明するためには、まず肺の構造を理解する必要がある。肺は咽頭、気管、気管支から肺胞へと、先へ行くに連れてサイズが小さくなっていく。咽頭では4.7~7.0μm、気管は3.3~4.7μm、気管支は1.1~3.3μm、さらに肺胞となると1.1μm以下となる。当然、入っていく粒子径すなわち粒子のサイズにより、どこまで入っていけるかが決まる。
「たとえばスギ花粉は30.0μmですから、まったく入らない。一方で、よく大気汚染で問題となるPM2.5は、まさに2.5μm以下ですから気管支にまで届いて作用する。だからPM2.5が飛ぶと、アレルギーや喘息に苦しむ人が出てくるのです」
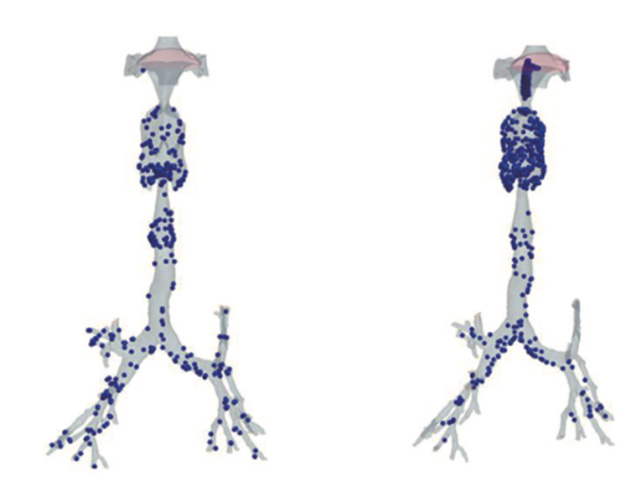
吸入薬である医薬品は、有機化合物であり微細な粒子とはなりにくい。そのため普通に吸い込むだけでは気管支に届かせることさえ難しい。実際にどれぐらいの量が、どの部分にまで入っていった結果、吸入薬としての効果をもたらしているのか。効果を測るためには、到達度を知りたいところだが、もとより人体実験による確認などは不可能である。
「そこで実験はできなくても、シミュレーションならできるのではないかと考えました。具体的には患者さんの肺の3次元CT画像を使って、気管支のモデルをコンピュータ上に作成します。このモデルを使って肺の中での空気の流れと薬の粒子の挙動をコンピュータ解析するのです。これにより粒子の大きさや吸い込む速さを変えたときの、肺の中での動きをシミュレーションできるようになります」
生命科学の実験は、まずin vitro(イン・ビトロ)と呼ばれる試験管内での実験に始まり、続いてin vivo(イン・ビボ)と呼ばれる生体内での実験へと進むのが、これまでのパターンだった。そこにコンピュータサイエンスの進化によって、in silico(イン・シリコ:シリコン=半導体材料)すなわちコンピュータ内での仮想実験も使われるようになっている。戸塚教授らの研究は、まさに最先端のin silicoの典型的な例である。
「これは、最先端領域の研究であり、それ故に実用化までには、まだいくつも解決すべき課題があります。そもそもシミュレーションの精度を高めるためには、よりコンピュータパワーが必要であるなど資金面も含めてさまざまなハードルを乗り越えなければなりません。もっとも吸入薬の研究には、すでに100年以上の歴史があります。つまり、それだけの時間をかけても、人間の肺の中を探るのは難しいのです」
研究成果を機能性食品に応用し、超高齢社会への貢献をめざす
薬効成分の吸収率を高める例として、戸塚教授はよく釣りのたとえ話を使う。
「胃腸を川と考えて、そこで釣りをするとします。魚をたくさん釣る、つまり薬をより多く吸収させるためには、どうすればよいでしょうか。まずは魚がたくさんいるのが大前提です。これは薬がたくさん溶けている状態に相当します。その上で、釣る人の腕がよくないと、いくら魚がたくさんいても釣れません。この釣り人の腕に相当するのが、薬の吸収されやすさです」
薬でも機能性食品にしても、まずは体の中でたくさん溶けている状態にするのが前提条件となる。そのうえで、溶けたものを吸収されやすくするのが製剤設計の課題となる。戸塚教授が今、力を入れているのが機能性食品の分野であり、その背景には世界に先駆けて高齢社会に突入した日本に対する危機感がある。
「高齢化が進み、健康を保てない人が増えれば医療費が膨れ上がります。そんな状態を防ぐためには、セルフメディケーション、つまり普段から自分の健康はできるだけ自分で維持するよう心がけなければなりません。そこで役に立つのが機能性食品、具体的には健康食品やサプリメントなどです。ただ、これらも水に溶けにくいものが多く、特に高齢の方が手軽に口にするのは難しい。これを溶けやすい状態にした上で、たとえばゼリー状などにできれば、おやつ感覚で手軽に食べられます。基礎研究はかなりのレベルにまで到達しているので、今後は産学連携などの取り組みも進めて、一般の方に提供していきたいと考えています」