INTRODUCTION
放射線が持つ、人を救う力
「放射線は、恐ろしいもの。そんなイメージを持つ人が、日本では多いようです。世界で唯一の被爆国だから、無理もない話だとは思うのですが、
実は放射線には人を救う力もあり、既に医療の現場では多く活用されています」と、天滿教授は放射線のメリットから語り始めた。

教授が学生時代に所属していたのは、放射性医薬品の研究室である。
そこで取り組んでいたのが、放射性酸素を用いたイメージングだった。
中でも脳内の循環代謝を対象とし、酸素がミトコンドリアでエネルギー変換される様子を、
PET(Positron Emission Tomography:陽電子放射断層撮影)で画像化して調べる。
正常組織であれば「グルコースのエネルギー変換」が「酸素の消費」となるが、
病態であればここの相関が崩れることがひとつのポイントだ。
このように体内での分子の動きを映像によって把握し、
各種診断などに役立つ情報を得る技術は、広く分子イメージングと呼ばれる。
教授によれば、PETをがん検診に応用するメカニズムは次のようになる。
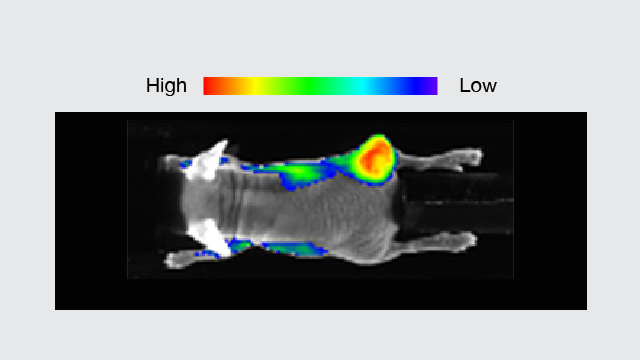
「陽電子を放出する放射性フッ素をブドウ糖と結合させて、体内に注射します。するとがん細胞は正常な細胞と比べてブドウ糖を多く取り込むため、がん細胞に放射性フッ素が集まります。
この、放射性フッ素から放出される放射線(γ線)をPETカメラでとらえれば、がん細胞の位置や大きさ、さらにはがんの進行度合いなども調べられます」
放射性医薬品には、このように診断用に使われるγ線を放出するものだけでなく、がん治療に使われるβ線を放出するものもある。
例えば放射線をうまく活用すれば、がんの診断と治療の両方に活用できるのだ。
救世主となりつつある新たながん治療法
治療と診断をあわせて行う「セラノスティクス」と呼ばれる医療技術がある。
治療(Therapeutics)と診断(Diagnostics)を組み合わせた造語が意味するのは、革新的な医療技術だ。
放射線を使った分子イメージングによってがん細胞を特定できれば、次は別の放射線を使ってがん細胞を破壊する。
具体的にはγ線を放出する医薬品を使ってがん細胞をイメージングし、続いてβ線やα線を放出する医薬品を使って治療するやり方だ。
「放射線を使う治療法としては、以前から内用療法、例えばヨウ素による甲状腺がんの治療が行われていました。ヨウ素は甲状腺ホルモンをつくる材料であり、甲状腺がんはヨウ素を多く取り込む機能を持っています。そこで、ヨウ素の放射性同位体を体内に入れれば、自然に甲状腺のがん細胞のまわりに集まり、放射線が、がん細胞を破壊してくれるのです。最近では前立腺がんの患者さんに、α線放出核種をつけた放射性医薬品を注射する治療が海外で行われるようになっています。この治療で体内に入れた放射性医薬品は、前立腺のがんだけでなく、全身に転移していたがんも破壊しました。20年ほど前、私が大学で研究室に配属された頃には、α線放出核種をつけた放射性医薬品を体内に入れるなんて、とんでもないこととされていました。α線は殺傷力が強すぎるので、体内に入れるなどありえないと当時は考えられていたのです。けれども医療の進化により、新たな常識が生まれています」

ただ放射線に対する扱いについて、日本はあくまで慎重である。一方で海外ではすでにβ線はもとよりα線を使う放射線療法も盛んに行われるようになっている。そして日本でも2021年、ついにβ線放出核種をつけた放射性医薬品が承認され、臨床の現場で使われ始めている。
セラノスティクスが進めば近い将来には、まずγ線で診断し、続けてβ線やα線を使って治療する手法が普及していくだろう。
20年前の非常識が20年後には常識に変わる。これが医療の進歩だ。その進歩をさらに加速させる研究に、天滿教授は取り組んでいる。
期待のがん治療を加速させる薬剤研究

大阪医科薬科大学には、関西BNCT共同医療センターが設立されている。
同センターはBNCTの専門施設であり、保険診療を行うだけでなく治療技術の向上に向けた研究にも取り組んでいる。
そこで2017年、本学に着任した天滿教授は、BNCTに使える新たな薬剤開発に取り組み始めた。
BNCTに使われるホウ素剤は、BSHとBPAがある。
BPAとBSHが開発されたのはいずれも1970年より前であり、逆に考えると、50年以上も新たな薬剤が開発されていないのが実態だ。
その理由を天滿教授は「おそらくは薬学系の研究者が少ないからでしょう。BNCTは第5のがん治療として注目されてはいますが、学問としてはBNCTはまだ限定された領域にとどまっています。
そのためがん学会が開かれても、BNCTに関するセッションは1つぐらいしかありません」と説明する。
そこに教授の問題意識が生まれた。
つまり50年も前に開発された薬剤が使い続けられている理由は、多くの人によって検証されていないからではないか。
あるいは、これまでの薬剤開発の過程で、何か見逃しなどが起きているのではないか。
BNCTの学会には、医学領域や工学領域、さらに理学系の研究者などが参加しているものの、薬学の研究者はあまりいないという。
そこで「分子イメージングの観点から、ホウ素製剤開発をゼロベースで見直すとどうなるのか」が、天滿教授の研究テーマとなった。
BPAには3種類(2位・3位・4位)の構造異性体がある。今のところBNCTに使われているのは4位の異性体、4-BPAだ。
では他の異性体については、どれだけの検証が行われているのか、あるいは現状の4-BPAに不具合はないのか。

「BNCTでは、治療のターゲットとなる腫瘍にホウ素製剤をできるだけ多く届ける必要があります。ホウ素製剤を取り込んだ腫瘍に中性子をあてると、ホウ素と中性子が反応することでα線とリチウム反跳核が放出され、その反応はホウ素が取り込まれた細胞内で生じるので、がん細胞が傷害される。
つまり腫瘍に届けられるホウ素製剤の量により治療効果が左右されます。製剤は点滴で投与されますが、実は4-BPAは水にほとんど溶けません。どうやって溶かすのかといえば、溶解補助剤として糖を加えます。そのため大量に4-BPAを投入しようとすれば、糖の体内投入量も点滴の液量も大量になります。」
大量の糖の添加が必要なほど水に溶けにくい4-BPAは、結晶尿や血尿といった副作用を引き起こすことがある。
なぜなら、4-BPAが体内から消失する過程で、排泄経路である腎臓で濃縮され高濃度となると、4-BPAが溶けきれずに結晶化してしまう可能性があるからだ。
全身状態の悪い進行したがん患者が、BNCTの適用となることを考えると、大量の糖や大量の点滴液量を必要としない、溶けやすいホウ素薬剤の開発が望まれることが理解できる。
天滿教授が4-BPAの構造異性体3-BPAについて、その有効性評価実験を行ったところ意外な結果が出た。
3-BPAもBNCT用薬剤として基礎的な有効な性質を持つことがわかったのだ。
研究成果を2020年の学会で発表すると、別の研究者から問い合わせが来た。
その問い合わせが、さらに意外な事実の発見につながった。
「問い合わせ内容は、3-BPAの溶解性についてでした。感覚的にはよく溶けるということはわかっていましたが、問い合わせもあった為、改めて定量的に溶解度を計測しました。驚くべきことに3-BPAは4-BPAと比べて、溶解補助剤無しで100倍以上も溶解性に優れていました。
単純に考えれば、同じ量のホウ素製剤を腫瘍に届けるなら、4-BPAの代わりに3-BPAを使えば、溶解補助剤として使われる糖の添加をなくすことができる可能性が出てきます」
研究成果をもとに特許申請が行われ、2022年5月にPharmaceutics誌において論文が公開されている。
“Evaluation of 3-Borono-l-Phenylalanine as a Water-Soluble Boron Neutron Capture Therapy Agent”
3-BPAを使ったホウ素製剤開発の産学連携共同研究は現在、ステラファーマ社と進められている。
次の常識を創り、医療に革新を起こす
天滿教授はBNCTの常識に対する検証を、さらに踏み込んで進めようとしている。
現状のBNCT薬剤開発の潮流では、ホウ素をがん細胞の細胞核にまで届けることを目指している。
ただ薬剤を細胞膜を通り抜けさせて、さらに細胞核にまで届けるのは決して簡単なプロセスではない。
「現時点のコンセンサスは“ホウ素が細胞核の中にあったほうががん細胞に与えるダメージは強くなる”です。けれども、それが唯一の真実なのかといえば、おそらくこれまで検証されていないのではないでしょうか。」
ーー例えば、わざわざ細胞核まで届けなくとも、細胞膜に薬剤をつけた段階でα線を放出させることでもがん細胞を倒せるのではないだろうか。
天滿教授がこの考えに至ったのは、上で述べたα線放出放射性医薬品が、前立腺がん細胞の細胞膜に発現するタンパク質を狙って作用しており、これがかなり劇的な治療効果を上げていることも背景にある。
「だからこそ、細胞膜に強固に結合するホウ素製剤を新たに開発し、その治療効果をこれまでの従来のホウ素製剤と比較してみたいのです。
薬剤開発のプロセスを考えるなら、細胞核ではなく細胞膜を狙うほうがよほど簡単にできますから」
天滿教授の発想が成果を示せば、製剤コストの抑制につながるだろう。あるいは製剤に使う材料についても、安価な候補が出てくる可能性もある。
天滿教授によれば「薬学の立場は、あくまで医療チームのサポーター」だという。
医療の最前線で主役となるのが医師だとすれば、医師をまわりで助けるのが薬学研究者の役目だ。医療の常識はいつも更新され続けている。
サポーター発の新たな常識にも、医療を飛躍的に進化させる可能性が秘められているのだ。
