研究テーマ
・医療への応用を志向した機能性分子の開発
・天然からの新規生理活性物質の探索及びそれらをシーズとした機能性分子の開発
キーワード
配属学生
| 大学院生 | 0名 |
|---|---|
| 学部学生 | 6年次生:11名、5年次生:13名、4年次生:16名 |
所属教員
-
平野 智也
教授 / 博士(薬学)
■担当科目
薬学入門(1年)、基礎薬学導入学習(1年)、医薬品化学1(3年)、医薬品化学2(4年)、有機化学1(1年)、有機化学4(3年)、有機スペクトル解析学(2年)、薬学連携演習3(1年)、薬学連携演習6(2年)、薬学連携演習10(2年)、統合薬学演習(6年)、薬学総合演習(6年)、特別演習・実習(4年~6年)
創薬化学演習(大学院)、創薬化学特論1, 2, 3(大学院)、薬化学特論(大学院)、特別演習(大学院)
■所属学会および社会活動
日本薬学会(近畿支部委員、ファルマシア委員)、日本化学会、日本ケミカルバイオロジー学会(世話人)、日本光医学・光生物学会(評議員) -
山田 剛司
准教授 / 博士(薬学)
■担当科目
化学(1年)、化学演習(1年)、有機化学1(1年)、有機化学4(3年)、有機スペクトル解析学(2年)、薬学連携演習3(1年)、薬学連携演習6(2年)、薬学連携演習10(2年)、基礎薬学導入学習(1年)、統合薬学演習(6年)、特別演習・実習(4年~6年)
生薬・天然物化学特論(大学院)、創薬化学特論1, 2, 3(大学院)
■所属学会および社会活動
日本薬学会、日本生薬学会 -
安田 大輔
助教 / 博士(薬学)
■担当科目
有機化学1(1年)、有機化学4(3年)、有機スペクトル解析学(2年)、薬学連携演習3(1年)、薬学連携演習6(2年)、薬学連携演習10(2年)、基礎薬学導入学習(1年)、統合薬学演習(6年)、薬学総合演習(6年)、特別演習・実習(4年~6年)
創薬化学演習(大学院)
■所属学会および社会活動
日本薬学会、日本酸化ストレス学会、日本ケミカルバイオロジー学会
Chem-Stationスタッフ
研究内容
(1)医療への応用を志向した光機能分子の開発
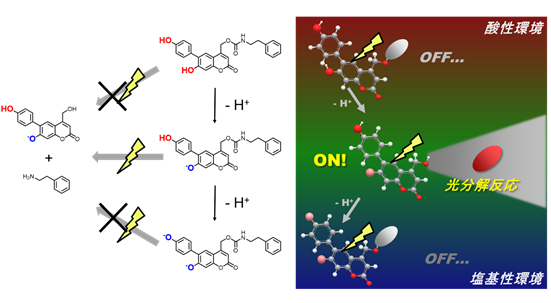
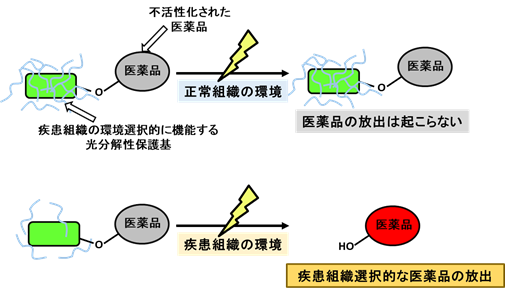
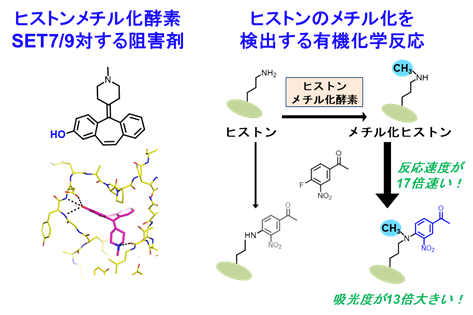
(2)エピジェネティクス、エピトランスクリプトームを制御、解析する分子の開発
(3)高槻市淀川流域のヨシを天然物の探索対象とする研究
その成分にアルツハイマー型認知症の予防効果を見出すことを目的とし、種々のカラムクロマトグラフィー及びHPLCを用いて分離・精製を行っています。現在、活性を示す幹皮のメタノールエキスの水溶性画分について検討を行い、これまで新規物質を含む数種の化合物を単離しています。

Phragmites australis
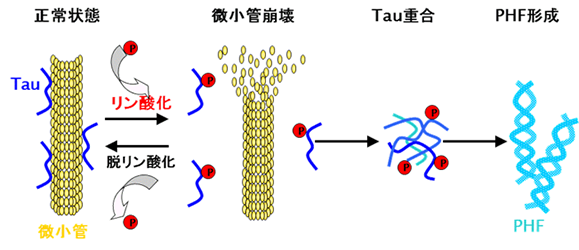
アルツハイマー型認知症の病理学的所見でみられるtauタンパク質によるPHF形成
(4)微生物コミュニケーションを利用した天然化合物探索の新しいアプローチ
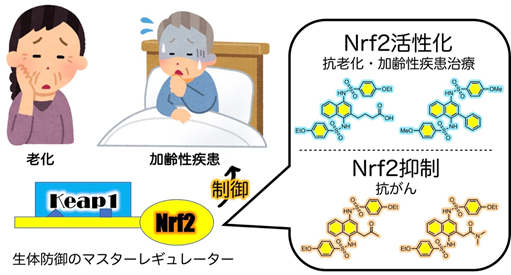
(5)生体防御と老化を制御する低・中分子化合物創薬
近年、老化は加齢に伴う自然現象だけではなく、疾病の一種とする考えが広まってきました。我々は老化や加齢性疾患 (がん、パーキンソン病、アルツハイマー病など)の新規治療標的として、生体防御を担うKeap1-Nrf2 系が有望であると考え、その制御を可能とする低〜中分子化合物を創成しています。これまでに、がん細胞の抗がん剤に対する感受性を増強するユニークな作用を持った分子を合成しています。
参考: Keap1-Nrf2系について
https://www.chem-station.com/blog/2021/01/nrf2.html
代表的論文
2025年
- Hirano T, Yasuda D, Yamada T, Kagechika H, Development of fluorescent estrogen receptor ligands with pH sensor functionality. Chem. Pharm. Bull. 73, 412, 2025
2023年
- Kikuchi T, Anami D, Morikawa S, Nakagawa Y, Li W, Yamada T, Hirano T: Secoergostane- and ergostane-type steroids from Pleurotus cornucopiae var. citrinopileatus Phytochemistry 206,113552, 2023
- Katagishi D, Yasuda D, Takahashi K, Nakamura S, Mashino T, Ohe T: Fullerene derivatives as inhibitors of SARS-Cov-2 main protease, Bioorg. Med. Chem. Lett, 80, 129121, 2023
- Kanehara R, Tanaka K, Yamada T, Koshino H, Hashimoto M: Termination of the chirality confusion of peribysins Bull.Chem.Soc.Jpn. 96, 318, 2023
- 山田 剛司, 菊地 崇: 抗がん剤, 特許第7334927号
2022年
- Usami Y, Mizobuchi Y, Ijuin M, Yamada T, Morita M, Mizuki K, Yoneyama H, Harusawa S: Synthesis of 6-halo-substituted pericosine A and an evaluation of their antitumor and antiglycosidase activities Mar. Drugs 20, 438, 2022
- Yasuda D, Yoshida I, Imamura R, Katagishi D, Takahashi K, Kojima H, Okabe T, Ichimura Y, Komatsu M, Mashino T, Ohe T: Development of p62-Keap1 Protein-Protein Interaction Inhibitors as Doxorubicin-Sensitizers Against Non-Small Cell Lung Cancer. Results Chem. 4, 100609,2022
- 平野智也、横尾英知、影近弘之、蛍光性天然物を基にした新規蛍光物質の創製、有機合成化学協会誌、80, 922, 202
2021年
- Kato D, Shiraishi T, Kagechika H, Hirano T: 6-Arylcoumarin as a Scaffold of Photofunctional Molecules with OFF–ON–OFF Type Regulation. J. Org. Chem., 86, 2264, 2021. (Selected as “Supplementary Journal Cover”)
- Takayanagi S, Watanabe K, Maruyama T, Ogawa M, Morishita K, Soga M, Hatta T, Natsume T, Hirano T, Kagechika H, Hattori K, Naguro I, Ichijo H: ASKA technology-based pull-down method reveals a suppressive effect of ASK1 on the inflammatory NOD-RIPK2 pathway in brown adipocytes. Sci. Rep., 11, 22009, 2021
- Asano A, Nakagawa C, Miyajima M, Yasui K, Minoura K, Yamada T, Doi M: Effect of the powerful plasticity of the tert-butyl side chain on the conformational equilibrium of ascidiacyclamides J. Pep. Sci. 27, e3363, 2021
2020年
- Yamada T, Kogure H, Kataoka M, Kikuchi T, Hirano T, Nehira T, Nishii T: Halosmysin A, a novel 14-membered macrodiolide isolated from the marine-algae-derived fungus Halosphaeriaceae sp. Mar. Drugs, 18, 320/1–320/9, 2020
- Kikuchi T, Akiyama K, Koike H, In Y, Yamada T, Tanaka R: Carapanins A-C: new limonoids from andiroba (Carapa guianensis) fruit oil. Org. Biomol. Chem., 18, 9268–9274, 2020
- Asano A, Minoura K, Kojima Y, Yoshii T, Yamada T, Doi M. NMR-based quantitative studies of the conformational equilibrium between their square and folded forms of ascidiacyclamide and its analogues. RSC Adv., 10, 33317–33326, 2020
- Kikuchi T, Mori M, In Y, Zhang J, Yamada T, Hirano T: leurocorols A and B: rearranged steroids from the fruiting bodies of Pleurotus cornucopiae. Org. Chem. Front., 7, 2022–2028, 2020
- Asano A, Yamada T, Doi M.Incorporation of β-amino acids into ascidiacyclamides: Effects on conformation, cytotoxicity and interaction with copper (II) ion. J. Pep. Sci., 25, e3225/1–e3225/10, 2020
- 平野智也、新たな構造・機能を持った光機能分子の開発、ファルマシア、56(12), 1112-1116, 2020
2019年
- H. Yokoo, H. Kagechika, A. Ohsaki, T. Hirano, A Polarity‐Sensitive Fluorescent Amino Acid and its Incorporation into Peptides for the Ratiometric Detection of Biomolecular Interactions, ChemPlusChem, 84, 1716-1719, 2019. (Featured in ChemistryViews Magazine, 15 December 2019, “Fluorescent Peptides Help to Detect Biomolecular Interactions”.)
- Yamada T, Tanaka R, Nehira T, Nishii T, Kikuchi T. Altercrasins A-E, decalin derivatives, from a sea-urchin-derived Alternaria sp.: isolation and structural analysis including stereochemistry. Mar. Drugs, 17, 218/1–218/10, 2019
- Inoue K, Tanaka K, Yamada T, Koshino H, Hashimoto M. Isolation of peribysins O, P, and Q from Periconia macrospinosa KT3863 and configurational reinvestigation of peribysin E diacetate from Periconia byssoides OUPS-N133. J. Nat. Pro., 82, 911–918, 2019
- Yamada T, Fujii A, Kikuchi T. New Diterpenes with a Fused 6-5-6-6 Ring System Isolated from the Marine Sponge-Derived Fungus Trichoderma harzianum. Mar. Drugs, 17, 480/1–10, 2019
- 平野智也、植物由来の天然物を基にした蛍光物質の創製、アグリバイオ、3(2), 61-65, 2019.
2018年
- Hirano T, Fujiwara T, Niwa H, Hirano M, Ohira K, Okazaki Y, Sato S, Umehara T, Maemoto Y, Ito A, Yoshida M, Kagechika H, Development of novel inhibitors for histone methyltransferase SET7/9 based on cyproheptadine. ChemMedChem, 13, 1530-1540 (2018) (Selected as “Cover Features”).
- Yokoo Y, Ohsaki A, Kagechika H, Hirano T, Unique properties of 1,5-naphthyridin-2(1H)-one derivatives as environmental-polarity-sensitive fluorescent dyes. Eur. J. Org. Chem. 679-687, 2018 (Selected as “Outstanding Organics”).
- Urushibara K, Masu H, Mori H, Azumaya I, Hirano T, Kagechika H, Tanatani A, Synthesis and Conformational Analysis of Alternately N‑Alkylated Aromatic Amide Oligomers. J. Org. Chem. 83, 14338-14349, 2018.
- Tojo Y, Urushibara K, Yamamoto S, Mori H, Masu H, Kudo M, Hirano T, Azumaya I, Kagechika H, Tanatani A, Conformational Properties of Aromatic Oligoamides Bearing Pyrrole Rings. J. Org. Chem. 83, 4606-4617, 2018.
- Sasayama A, Akita K, Ohya H, Kikuchi T, In Y, Fujitake M, Yamada T, Tanaka R: Guianofruits A and B from the fruit oil of andiroba (Carapa guianensis, Meliaceae) and their effects on LPS-activated NO Production. Chem.Select, 3:6056-6060, 2018
- Kikuchi T, Kitaura K, Katsumoto A, Zhang J, Yamada T, Tanaka R: Three bisabolane-type sesquiterpenes from edible mushroom Pleurotus eryngii. Fitoterapia, 129:108-113, 2018
- Yamada T, Matsyda M, Seki M, Hirose M, Kikuchi T: Sterepinic acids A-C, new carboxylic acids produced by a marine alga-derived fungus. Molecules, 23:1336/1-1336/10, 2108
- Inoue T, Ohmori S, Ohya H, Kikuchi T, Yamada T, Tanaka R: Carapanosins D-F from the seeds of andiroba (Carapa guianensis, Meliaceae) and their effects on LPS-activated NO production. Molecules, 23:1778/1-1778/9, 2108
- Zhang J, Zhu W-F, Zhu W-Y, Yang P-P, Xu J, Manosroi J, Kikuchi T, Abe M, Akihisa T, Feng F: Melanogenesis-inhibitory and cytotoxic activities of chemical constituents from the leaves of Sauropus androgynus L. MERR. (Euphorbiaceae). Chem. Biodivers., 15: e1700486, 2018
- Zhang J, Akihisa T, Kurita M, Kikuchi T, Zhu W-F, Ye F, Dong Z-H, Liu W-Y, Feng F, Xu J: Melanogenesis-inhibitory and cytotoxic activities of triterpene glycoside constituents from the bark of Albizia procera. J. Nat. Prod., 81: 2612-2620, 2018
- Miao D., Zhang T-Q, Xu J, Ma C-Y, Liu, W-Y, Kikuchi T, Akihisa T, Abe M, Feng F, Zhang J: Three new cardiac glycosides obtained from the roots of Streblus asper Lour. and their cytotoxic and melanogenesis-inhibitory activities. RSC Adv., 8: 19570-19579, 2018
- Morikawa T, Nagatomo A, Kitagawa K, Muraoka O, Kikuchi T, Yamada T, Tanaka R, Ninomiya K: Collagen synthesis-promoting effects of andiroba oil and its limonoid constituents in normal human dermal fibroblasts. J. Oleo Sci., 67: 1271-1277, 2018
- Yamada T, Kajimoto J, Kikuchi T, Tanaka R: Elucidation of the relationship between CD Cotton effects and the absolute configuration of sixteen stereoisomers of spiroheterocyclic-lactams. Mar. Drugs 16: 223/1–223/12, 2018
- Hirano T, Mori S, Kagechika H, Development of functional molecules for regulating and elucidating histone methyltransferase. Chemical Record, 18, 1745-1759, 2018.
2017年
- Mori S, Hirano T, Takaguchi A, Fujiwara T, Okazaki Y, Kagechika H, Selective reagent for detection of N-ε-monomethylation of peptide lysine residue via SNAr reaction. Eur. J. Org. Chem. 3606-3611, 2017.
- Endo Y, Kasahara T, Harada K, Kubo M, Etoh T, Ishibashi M, Ishiyama A, Iwatsuki M, Otoguro K, Omura S, Akisue G, Hirano T, Kagechika H, Fukuyama Y, Ohsaki A, Sucupiranins A−L, Furanocassane Diterpenoids from the Seeds of Bowdichia virgilioides. J. Nat. Prod. 80, 3120−3127, 2017.
- Yamada T, Suzue M, Arai T, Kikuchi T, Tanaka R: Trichodermanins C–E, new diterpenes with a fused 6-5-6-6 ring system produced by a marine sponge-derived fungus. Mar. Drugs, 15:169/1-169/7, 2017
- Yamada T, Kimura H, Arimitsu T, Kajimoto T, Kikuchi T, Tanaka R: Absolute configuration of eight cephalimysins isolated from the marine-derived Aspergillus fumigatus. ChemistrySelect, 2: 10936 -10940, 2017
- Asano A, Numata S, Yamada T, Minoura K, Doi M: Conformational properties of ascydiacyclamide analogues with cyclic α-amino acids instead of oxazoline residues. Bioorg. Med. Chem., 25: 6554-6562, 2017
- Higuchi K, Tani Y, Kikuchi T, In Y, Yamada T, Muraoka O, Tanaka N, Tanaka R: Guianolactones A and B, two rearranged pentacyclic limonoids from the seeds of Carapa guianensis. Chem.-Asian J., 12: 3000-3004, 2017
- Kikuchi T, Horii Y, Maekawa Y, Masumoto Y, In Y, Tomoo K, Sato H, Yamano A, Yamada T, Tanaka R: Pleurocins A and B: unusual 11(9→7)-abeo-ergostanes and eringiacetal B: A 13,14-seco-13,14-epoxyergostane from fruiting bodies of Pleurotus eryngii and their inhibitory effects on nitric oxide production. J. Org. Chem., 82: 10611-10616, 2017
- Kikuchi T, Ueno Y, Hamada Y, Furukawa C, Fujimoto T, Yamada T, Tanaka R: Five new limonoids from peels of satsuma orange (Citrus reticulata). Molecules, 22: 907/1-907/10, 2017
- Higuchi K, Miyake T, Ohmori S, Tani Y, Minoura K, Kikuchi T, Yamada T, Tanaka R: Carapanosins A-C from seeds of andiroba (Carapa guianensis, Meliaceae) and their effects on LPS-activated NO production. Molecules, 22: 502/1-502/9, 2017
- Kikuchi T, Motoyashiki N, Yamada T, Shibatani K, Ninomiya K, Morikawa T, Tanaka R: Ergostane-type sterols from king trumpet mushroom (Pleurotus eryngii) and their inhibitory effects on aromatase. Int. J. Mol. Sci., 18: 2479/1-2479/10, 2017
- 平野智也、森修一、影近弘之「ヒストンメチル化酵素を標的とする創薬およびケミカルバイオロジー研究」MedChemNews, 27(4), 208-212, 2017.
2016年
- Hirano T, Noji Y, Shiraishi T, Ishigami-Yuasa M, Kagechika H, Development of an ‘OFF-ON-OFF’ fluorescent pH sensor suitable for the study of intracellular pH. Tetrahedron 72, 4925-4930, 2016.
- Yokoo H, Ohsaki A, Kagechika H, Hirano T, Structural development of canthin-5,6-dione moiety as a fluorescent dye and its application to novel fluorescent sensors. Tetrahedron 72, 5872-5879, 2016.
- Fujiwara T, Ohira K, Urushibara K, Ito A, Yoshida M, Kanai M, Tanatani A, Kagechika H, Hirano T, Steric structure-activity relationship of cyproheptadine derivatives as inhibitors of histone methyltransferase SET7/9. Bioorg. Med. Chem. 24, 4318-4323, 2016.
- Takemoto Y, Ito A, Niwa H, Okamura M, Fujiwara T, Hirano T, Handa N, Umehara T, Sonoda T, Ogawa K, Tariq M, Nishino N, Dan S, Kagechika H, Yamori T, Yokoyama S, Yoshida M, Identification of cyproheptadine as an inhibitor of SET domain containing lysine methyltransferase 7/9 (Set7/9) that regulates estrogen-dependent transcription, J. Med. Chem. 59, 3650-3660, 2016.
- Kinoshita M, Negishi M, Sakai H, Hirano T, Mori S, Fujii S, Kagechika H, Tanatani A, Development of 6-Arylcoumarins as Nonsteroidal Progesterone Antagonists. Structure-activity Relationships and Fluorescence Properties. Bioorg. Med. Chem. 24, 5602-5610, 2016.
- Yamada T, Ohshima M, Yuasa K, Kikuchi T, Tanaka R: Assignment of the CD cotton effect to the chiral center in pseurotins, and the stereochemical revision of pseurotin A2. Mar. Drugs, 14:e74, 2016
- Suzue M, Kikuchi T, Tanaka R, Yamada T: Tandyukisins E and F, novel cytotoxic decalin derivatives isolated from a marine sponge-derived fungus. Tetrahedron Lett., 57:5070-5073, 2016
- Ninomiya K, Miyazawa S, Ozeki K, Matsuo N, Muraoka O, Kikuchi T, Yamada T, Tanaka R, Morikawa T: Hepatoprotective limonoids from andiroba (Carapa guianensis). Int. J. Mol. Sci., 17:e591, 2016
- Kikuchi T, Tanaka A, Uriuda M, Yamada T, Tanaka R: Three Novel Triterpenoids from Taraxacum officinale roots. Molecules, 21:e1121, 2016
- Kikuchi T, Maekawa Y, Tomio A, Masumoto Y, Yamamoto T, In Y, Yamada T, Tanaka R: Six new ergostane-type steroids from king trumpet mushroom (Pleurotus eryngii) and their inhibitory effects on nitric oxide production. Steroids, 115:9-17, 2016
- Asano A, Minoura K, Yamada T, Doi M: Conformational transformation of ascidiacyclamide analogs induced by incorporating enantiomers of phenylalanine, 1-naphthylalanine or 2-naphthylalanine. J. Pept. Sci., 22:156-165, 2016
- Baba S., Ueno Y., Kikuchi T., Tanaka R., Fujimori K.: A Limonoid kihadanin B from immature Citrus unshiu peels suppresses adipogenesis through repression of the Akt-FOXO1-PPARγ axis in adipocytes. J. Agric. Food Chem., 64:9607-9615, 2016