研究テーマ
・元素多様化による医薬品化合物の新しい分子設計手法の開発と実証
・核酸医薬を細胞内に送り込むペプチド性キャリアの開発
・ミトコンドリア機能改善を目的とした低分子医薬品の開発
・核酸医薬に用いられる化学修飾核酸の創製
キーワード
配属学生
| 大学院生 | 1名 |
|---|---|
| 学部学生 | 6年次生:6名、5年次生:10名、4年次生:6名 |
所属教員
-
藤井 晋也
教授 / 博士(薬学)
■担当科目
有機化学1、有機化学4、有機化学実習、薬学総合演習
薬化学特論(大学院)、創薬化学Ⅰ,Ⅱ,Ⅲ(大学院)、創薬化学演習(大学院)
■所属学会および社会活動
日本薬学会、日本化学会、日本ケミカルバイオロジー学会、日本ビタミン学会
日本薬局方原案検討委員会委員
-
和田 俊一
准教授 / 博士(薬学)
■担当科目
基礎有機化学(1年)、有機化学1(1年)、有機化学実習(3年)、
薬化学特論(大学院)、創薬化学Ⅰ,Ⅱ,Ⅲ(大学院)、創薬化学演習(大学院)
■所属学会および社会活動
日本薬学会、日本薬学会医薬化学部会、日本ペプチド学会 -
懸樋 涼
助教 / 博士(工学)
■担当科目
有機化学実習(3年)
■所属学会および社会活動
日本薬学会、日本薬学会医薬化学部会、日本化学会
研究内容
(1)元素多様化による医薬品化合物の新しい分子設計手法の開発と実証
従来の低分子医薬品開発では一般的に、炭化水素を骨格構造に用い、窒素、酸素、硫黄やハロゲン原子を用いた構造展開が検討されてきましたが、その他の元素も、医薬品として様々なポテンシャルを有していると考えられます。私たちは、そのような「非汎用元素」の持つ可能性に着目し、元素多様化というアプローチを基盤とする医薬品化合物の新しい分子設計手法の開発と実証を行っています。
①有機金属化合物の特性を活用した分子設計
フェロセンやルテノセンなどのサンドイッチ型有機金属化合物は、独特な三次元構造を有し、複数の非対称な置換位置が存在するために、三次元分子構築のプラットフォーム構造として優れています。私たちは、そのような有機金属化合物を用いた生物活性化合物の分子設計手法の提案を行い、医薬品化合物としての可能性の実証を行っています。また、多置換フェロセン誘導体の合成法の開発も行っています。
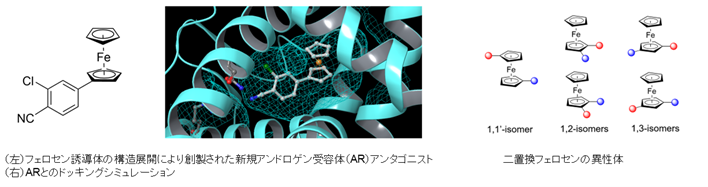
参考論文
②リン官能基を用いた生物活性化合物の分子設計
リンは様々な酸化数を取り、また種々の元素と安定な結合を形成する元素ですが、医薬品としてはリン酸誘導体あるいはホスホン酸誘導体としての利用が主であり、その他の化学種の可能性が十分には検討されていません。私たちは、リン官能基の中でもホスフィンボランやホスフィンアミドなどの特徴的なヘテロ原子結合を有する化学種に着目し、それらの特徴を活用した生物活性化合物の開発を行っています。
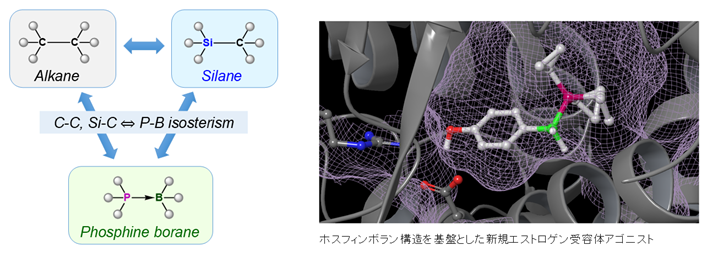
参考論文
③ケイ素官能基を用いた構造展開手法の開発
ケイ素は周期表上で炭素と同族の元素であり、炭素とはある程度の共通した性質を持ちますが、有機ケイ素化合物は対応する炭素化合物とは異なる構造特性や反応性を示します。私たちは、そのような有機ケイ素化合物が持つユニークな反応性や構造特性を活用した生物活性化合物の分子設計手法の提案を行っています。
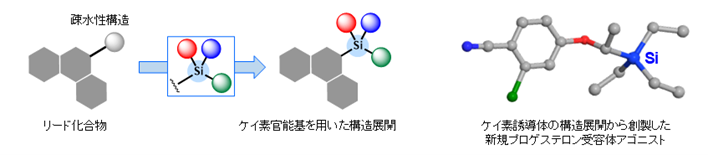
参考論文
(2)核酸医薬のペプチド性キャリアの開発
『核酸医薬』の臨床応用の障壁となっている1つの問題点は、『核酸医薬』に用いられる核酸分子自体が極性高分子化合物であるため細胞膜を透過できず、その機能を発現できない点があげられます。我々の研究室ではその問題を解決するため、α-aminoisobutyric acid(Aib, U)含有膜透過性ペプチドを設計し、核酸医薬のペプチド性キャリアの開発を行っています。我々の研究室でデザインしたペプチド性キャリアは、疎水性アミノ酸(Aib,Leu,Ala)と塩基性極性アミノ酸(Lys)を組み合わせた両親媒性ヘリックスペプチド [MAP(Aib) と命名] で、さらにがん細胞選択性を上げるために、がん細胞膜上に過剰に発現している αvβ3 インテグリンレセプターに特異的に結合するRGD(Arg-Gly-Asp)配列を MAP(Aib) に結合させています。これらのデザインペプチドが、siRNA を細胞内に輸送するキャリアとしての機能を有すること、さらに細胞内に輸送されたsiRNAがRNAi 効果を発揮することを明らかにしました。

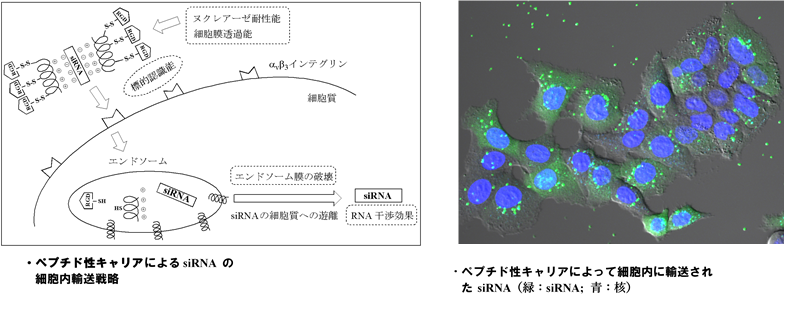
参考論文
(3)ミトコンドリア機能改善を目的とした低分子医薬品の開発
ミトコンドリア病は、ミトコンドリアDNAまたは核DNAの異常に起因する酸化的リン酸化の機能不全により、ATP産生が著しく低下する疾患群です。ミトコンドリア機能が低下した細胞では、エネルギー産生を補うために解糖系が過剰に活性化される傾向がありますが、この代謝シフトがしばしば細胞全体の代謝の不均衡と病態進行に拍車をかけます。近年、解糖系律速酵素Phosphofructokinase-1(PFK-1)の活性を選択的に阻害することにより、ミトコンドリアの呼吸活性が相対的に回復することが明らかになりました。このことから、PFK-1阻害剤はミトコンドリア病における代謝異常を是正する有望な治療標的として注目されています。現在、私たちは構造活性相関研究および合理的な薬物設計に基づいて、選択的かつ高活性なPFK-1阻害剤の創製を進めており、ミトコンドリア病に対する新規治療薬としての開発を目指しています。
参考論文
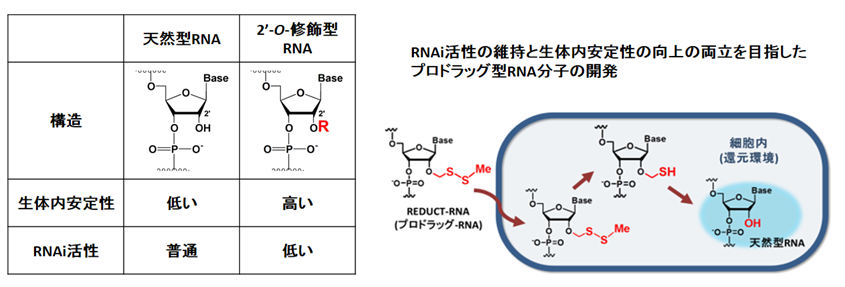
(4)細胞内還元環境に応答するプロドラッグ型核酸分子の開発
RNA干渉(RNAi)は、細胞内でsiRNA(small interfering RNA)と呼ばれる20塩基対程度の二本鎖RNAによって、特定のmRNAの発現を抑制する生命現象です。現在、病態の原因となるmRNAをターゲットとしたsiRNAを化学合成し、それを『核酸医薬』として用いる研究が世界中で進められています。しかし生体内にはRNA分解酵素が多く存在するため、siRNAは生体内で非常に分解されやすく、このことが『核酸医薬』の臨床応用における大きな問題となっています。
この問題を解決するために、RNAの糖部2’-OH基に化学修飾を加えた2’-O-修飾型RNA(図)が用いられていますが、これらの修飾核酸はRNAi活性が大きく低下するため、強いRNAi活性と生体内での安定性の両立は困難であると考えられています。
そこで、我々の研究室ではsiRNAの生体内での安定性向上とRNAi活性の維持の両立を目指し、プロドラッグ型RNAとして細胞内還元環境で天然型へと変換するREDUCT RNA (Reducing-Environment-Dependent Uncatalyzed Chemical Transforming RNA) を開発しました(図)。現在、この分子を利用したsiRNAの遺伝子抑制効果を、細胞を用いたin vitroでの実験により詳細に検討中で、既に本分子が化学的に修飾していない天然型核酸よりも優れた遺伝子抑制活性を示すことを明らかにしています。
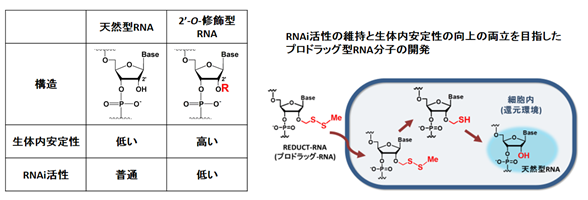
参考論文
代表的論文
2024年
- 藤井晋也: 元素多様化を基盤とした生物活性化合物の創製研究—創薬化学における新しい多元素ケミカルスペースの開拓—. 有機合成化学協会誌,82:1170-1183, 2024
- Ochiai K, Yonezawa R, Fujii S: Structural development of androgen receptor antagonists using phenylferrocene framework as a hydrophobic pharmacophore. ChemMedChem, 19:e202400040, 2024
- Miyajima Y, Noguchi-Yachide T, Ochiai K, Fujii S: Physicochemical characterization of B-hydroxyphenyl phosphine borane derivatives and their evaluation as nuclear estrogen receptor ligands. RSC Med. Chem., 15:119-126, 2024
- Miyajima Y, Ochiai K, Fujii S: Design, synthesis, and evaluation of B-(trifluoromethyl)phenyl phosphine–borane derivatives as novel progesterone receptor antagonists. Molecules, 29:1587, 2024
- Namba N, Fujii S: Hydroboration of vinylsilanes providing diversity-oriented hydrophobic building blocks for biofunctional molecules. Org. Biomol. Chem., 22:6115-6121, 2024
- Hayashi J, Ochi Y, Senpuku K, Wada S, Wada F, Harada-Shiba M, Urata H: Rational design of prodrug-type apoB-targeted siRNA for nuclease resistance improvement without compromising gene silencing potency. Bioorg. Med. Chem., 104:117693, 2024
- Funai T, Tanaka N, Sugimachi R, Wada S, Urata H, Zn2+ ions improve the fidelity of metal-mediated primer extension while suppressing intrinsic and Mn2+-induced mutagenic effects by DNA polymerases, Org. Biomol. Chem. 22:9094-9100, 2024
- Kakehi R, Kobayashi H, Mashiyama H, Yajima T, Koyama H, Ito T K, Yoshida M, Nagaoka Y, Sumiyoshi T: Asymmetric synthesis, structure determination, and biologic evaluation of isomers of TLAM as PFK1 inhibitors. ACS Med. Chem. Lett., 16:59-63, 2025
2023年
- Sugimoto N. Hayashi J. Funaki R. Wada S. Wada F. Harada-Shiba M. Urata H: Prodrug-type phosphotriester oligonucleotides with linear disulfide promoieties responsive to reducing environment. ChemBioChem, 24: e202300526, 2023
- 和田俊一、林淳祐、浦田秀仁、谷口高平:第7章 第6節 Aib含有ペプチド性キャリアによる核酸医薬の細胞内移送技術 ”新規モダリティ医薬品のための新しいDDS技術と製剤化” 技術情報協会;pp. 410-416, 2023
2022年
- Wada S, Shibaike A, Hayashi J, Urata H:Influence of Aib-containing amphipathic helical chain length in MAP(Aib)-cRGD as carrier for siRNA delivery. Chem & Biodiv., 19: e202100728, 2022.
2021年
- 林 淳祐、和田 俊一、浦田 秀仁: 第3章 第3節 核酸医薬における化学修飾核酸の概要と研究開発 “医薬品におけるDDS技術開発と製剤への応用” 233-247, 2021
2020年
- Funai T, Tagawa C, Nakagawa O, Wada S,Ono A, Urata H:Enzymatic formation of consecutive thymine–HgII–thymine base pairs by DNA polymerases. Chem. Commun., 56:12025-12028, 2020
- Funai T, Aotani M, Kiriu R, Nakamura J, Miyazaki Y, Nakagawa O, Wada S, Torigoe H, Ono A, Urata H:Silver(I)-Ion-Mediated Cytosine-Containing Base Pairs: Metal Ion Specificity for Duplex Stabilization and Susceptibility toward DNA Polymerases. ChemBioChem, 21:517-522, 2020
- Funai T, Adachi N, Aotani M, Wada S, Urata H.:Effects of metal ions on thermal stabilities of DNA duplexes containing homo- and heterochiral mismatched base pairs: comparison of internal and terminal substitutions. Nucleosides, Nucleotides and Nucleic Acids, 39:310-321, 2020
- 林 淳祐、和田 俊一、浦田 秀仁:REDUCT-siRNA:細胞内還元環境に応答して活性化するプロドラッグ 型RNA創薬.Medical Science Digest, 46:582-585
2019年
- Wada S, Taniguchi K, Hamazaki H, Yamada A, Hayashi J, Uchiyama K, Urata H: Influence of lysine residue in amphipathic helical peptides on targeted delivery of RNA into cancer cells. Bioorg. Med. Chem. Lett., 29:1934-1937, 2019
- Taniguchi K, Wada S, Ito Y, Hayashi J, Inomata Y, Lee S.-W, Tanaka T, Komura K, Akao Y, Urata H, Uchiyama K: α-Aminoisobutyric acid-containing amphipathic helical peptide-cyclic RGD conjugation as a potential drug delivery system for microRNA replacement therapy in vitro. Mol. Pharm., 16:4542-4550 2019
2018年
- Hayashi J, Ochi Y, Morita Y, Soubou K, Ohtomo Y, Nishigaki M, Tochiyama Y, Nakagawa O, Wada S, Urata H: Syntheses of prodrug-type 2’-O-methyldithiomethyl oligonucleotides modified at natural four nucleoside residues and their conversions into natural 2’-hydroxy oligonucleotides under reducing condition. Bioorg. Med. Chem. , 26:5838-5844, 2018
- Hayashi J, Nishigaki M, Ochi Y, Wada S, Wada F, Nakagawa O, Obika S, Harada-Shiba M, Urata H: Effective gene silencing activity of prodrug-type 2'-O-methyldithiomethyl siRNA compared with non-prodrug-type 2'-O-methyl siRNA. Bioorg. Med. Chem. Lett. , 28:2171-2174, 2018
- Yamashita M, Tahara T, Hayakawa S, Matsumoto H, Wada S, K Tomioka, Iida A: Synthesis and biological evaluation of histone deacetylase and DNA topoisomerase II-targeted inhibitors. Bioorg. Med. Chem. , 26:1920-1928, 2018
2017年
- Hayashi J, Samezawa Y, Ochi Y, Wada S, Urata H: Syntheses of prodrug-type phosphotriester oligonucleotides responsive to intracellular reducing environment for improvement of cell membrane permeability and nuclease resistance., Bioorg. Med. Chem. Lett., 27:3135-3138, 2016
- Wada S, Takesada A, Nagamura Y, Sogabe E, Ohki R, Hayashi J, Urata H: Structure-activity relationship study of Aib-containing amphipathic helical peptide-cyclic RGD conjugates as carriers for siRNA delivery., Bioorg. Med. Chem. Lett., 27:5378-5381, 2016
- H. Matsumoto, M. Yamashita, T. Tahara, S. Hayakawa, S. Wada, K. Tomioka,, A. Iida: Design, synthesis, and evaluation of DNA topoisomerase II-targeted nucleosides. Bioorg. Med. Chem., 25:4133-4144, 2017
- 和田俊一、浦田秀仁:第IV編 第3章 核酸医薬のデリバリーを指向したAib含有ペプチドの創製, "医療・診断をささえるペプチド科学-再生医療・DDS・診断への応用-" 平野義明監修,シーエムシー出版(東京)pp. 239-247, 2017
2016年
- Ochi Y, Imai M, Nakagawa O, Hayashi J, Wada S, Urata, H: Gene silencing by 2’-O-methyldithiomethyl-modified siRNA, a prodrug-type siRNA responsive to reducing environment., Bioorg. Med. Chem. Lett., 26:845-848, 2016
- Wada S, Iwata M, Ozaki Y, Ozaki T, Hayashi J, Urata H: Design of cyclic RGD-conjugated Aib-containing amphipathic helical peptides for targeted delivery of small interfering RNA., Bioorg. Med. Chem., 24:4478-4485, 2016
- 中川治,越智洋輔,林淳祐,和田俊一,浦田秀仁: REDUCT-siRNA:プロドラッグ型siRNA分子による優れた遺伝子抑制効果, 生産と技術, 68:72-76, 2016
- 浦田秀仁,和田俊一: 核酸医薬のデリバリーを指向した機能性核酸・ペプチド関連分子の創製, 化学工業, 67: 48-60, 2016
2015年
- Hayashi J, Hamada T, Sasaki I, Nakagawa O, Wada S, Urata, H: Synthesis of novel cationic spermine-conjugated phosphotriester oligonucleotide for improvement of cell membrane permeability., Bioorg. Med. Chem. Lett., 25:3610-3615, 2015
- Ochi Y, Nakagawa O, Hayashi J, Wada S, Urata, H: A new nucleic acid prodrug responsive to high thiol concentration: synthesis of 2'-O-methyldithiomethyl-modified oligonucleotides by post-synthetic modification., Curr. Protoc. Nucleic Acid Chem., 62:4.63.1-4.63.20, 2015
- Tanaka Y, Kondo J, Sychrovský V, Šebera J, Dairaku T, Saneyoshi H, Urata H, Torigoe H, Ono A: Structures, physicochemical properties, and applications of T–HgII–T, C–AgI–C, and other metallo-base-pairs., Chem Commun., 51:17343-17360, 2015.