研究テーマ
生体内で働く酵素や情報伝達タンパク質の機能を分子レベルで解明する。
キーワード
配属学生
| 大学院生 | 0名 |
|---|---|
| 学部学生 | 6年次生:10名、5年次生:14名、4年次生:17名 |
研究内容
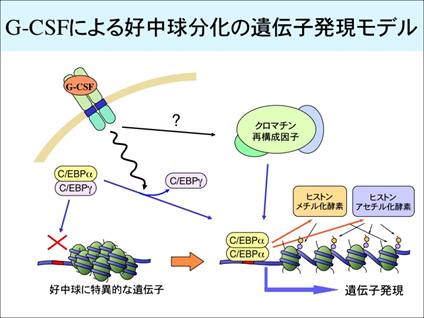
(1)G-CSFによる好中球の増殖・分化・機能発現の分子機構の研究
顆粒球コロニー刺激因子(G-CSF)は、骨髄球前駆細胞の増殖・分化を促進して好中球を産生するサイトカインです。G-CSFによる好中球産生の分子メカニズムを解明するために、G-CSF受容体の活性化に続いて起こる細胞内シグナル伝達と遺伝子発現制御について研究しています。具体的には,好中球分化に必須な役割を果たす転写因子であるC/EBPαがG-CSFによって活性化されるしくみを解明するために、C/EBPαの翻訳後修飾やC/EBPαに会合するタンパク質について解析しています。また、炎症制御における好中球の役割を解明するために、活性化好中球が産生するサイトカインを探索・同定し、その作用機構を解析しています。
参考論文
- J. Biol. Chem., 285:30214-30223, 2010
- Genes Cells,13:313-327, 2008
- Genes Cells, 12:581-592, 2007
- J. Leukoc. Biol., 78:481-490, 2005
- Cell, 74:1079-1087, 1993
- Cell, 61:341-350, 1990
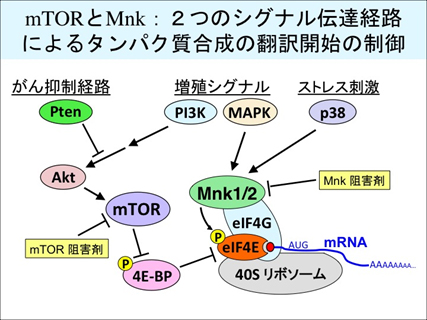
(2)MAPキナーゼ情報伝達系による細胞増殖・機能制御の分子機構の研究
MAPキナーゼカスケードは、増殖因子や細胞ストレスなどの刺激によって活性化される細胞内情報伝達系であり、細胞の増殖・分化や細胞機能の制御に重要な役割を果たしてます。私たちは,これらの情報伝達機構を解明するために、MAPキナーゼの標的タンパク質(生理的基質)を探索・同定して解析しています。私たちが発見したMnkはMAPキナーゼによって活性化されるプロテインキナーゼです。Mnkはタンパク質合成の翻訳開始を制御すると考えられており、その活性制御機構や生理機能の解析を進めています。また、MAPキナーゼによってリン酸化されるプロテインホスファターゼや新規タンパク質の分子機能や生理的機能の解析を進めています。
参考論文
- Proc. Natl. Acad. Sci. USA, 107:13984-13990, 2010
- Genes Dev., 21:3232-3237, 2007
- Genes Cells, 10:851-860, 2005
- Mol. Cell. Biol., 24:6539-6549, 2004
- EMBO J., 16:1921-1933, 1997
(3)リン脂質加水分解酵素の触媒機能の解明
私たちは、リン脂質加水分解酵素、特に、発痛物質であるプロスタグランジンの前駆体であるアラキドン酸の産生に係わるホスホリパーゼA2(PLA2)と、細胞のアポトーシスを誘導するセラミドの産生に係わるスフィンゴミエリナーゼ(SMase)を生体から精製、もしくは、大腸菌を用いた発現系を構築して精製し、酵素反応速度論に基づいて種々の実験を行いました。その結果、PLA2はHis48を触媒基とし、SMaseはHis296を触媒基とすることがわかりました。また、それぞれの酵素は、種々の金属イオンによって酵素活性が調節されていることを明らかにしました。今後は、これら2つの酵素の触媒機構を詳細に調べ、他のリン脂質加水分解酵素についても同様な研究を進める予定です。
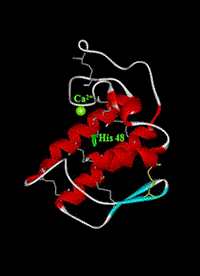
PLA2の構造と触媒基
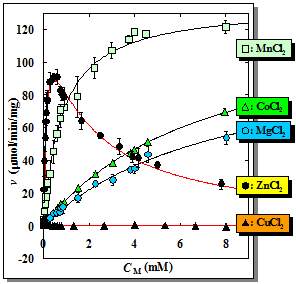
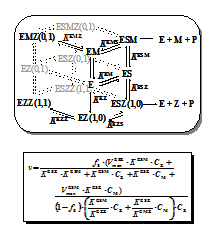
SMaseと金属イオンとの相互作用
グラフ内のシンボルは実験値、
実線は上記の理論式に基づく理論曲線
参考論文
- Arch. Biochem. Biophys., 436:227-236, 2005
- Biol. Pharm. Bull., 26:920-926, 2003
- Toxicol. Toxin Reviews, 17:279-313, 1998
(4)リン脂質加水分解酵素の低分子阻害剤による阻害機構の解明
リン脂質加水分解酵素は生体膜成分のリン脂質を加水分解し、種々の生理活性を持つ物質を産生します。このような反応過程を阻害する物質を見つけることができれば、抗炎症薬などの開発などにつながります。そこで、私たちは、PLA2やSMaseの阻害物質を探索する研究を行っています。実際にはPLA2の基質と類似した物質が酵素の基質結合部位に結合し阻害することを明らかにしました。
参考論文
- J. Nat. Prod., 71:1089-1091, 2008
- Tetrahedron Letters, 47:2627-2630, 2006
代表的論文
福永 理己郎
2024年
- Shirai R, Shibata K, Fujii S, Fukunaga R, Inoue S: One-Step Affinity Purification of Leucine-Rich α2-Glycoproteins from Snake Sera and Characterization of Their Phospholipase A2-Inhibitory Activities as β-Type Phospholipase A2 Inhibitors. Toxins 16(3): 126-126 2024. doi: 10.3390/toxins16030126
- Tian Q, Yin Y, Tian Y, Wang Y, Wang Y, Fukunaga R, Fujii T, Liao A, Li L, Zhang W, He X, Xiang W and Zhou L
Chromatin Modifier EP400 Regulates Oocyte Quality and Zygotic Genome Activation in Mice
Advanced Science, 11, 1-21 (2024), (DOI: 10.1002/advs.202308018)
2023年
- Fujii T, Inoue N, Nobeyama T, Inoue J, Ogasawara S, Otani Y, Fujii S, Ito C, and Fukunaga R: A simple, rapid, and efficient method for generating multigene-knockout culture cells by the CRISPR/Cas9 system. Genes to Cells, 28(5): 390-397, 2023. doi: 10.1111/gtc.13021.
2022年
- Liu D, Li J, Lin H, Lorsung E, Le N, Singla R, Mishra A, Fukunaga R, and Cao R: Circadian activities of the brain MNK-eIF4E signalling axis contribute to diurnal rhythms of some cognitive functions. Eur. J. Neurosci., 56, 3553-3569, 2022. doi: 10.1111/ejn.15678.
- Manne BK, Campbell RA, Bhatlekar S, Ajanel A, Denorme F, Portier I, Middleton EA, Tolley ND, Kosaka Y, Montenont E, Guo L, Rowley JW, Bray PF, Jacob S, Fukunaga R, Proud C, Weyrich AS, and Rondina MT: MAPK-interacting kinase 1 regulates platelet production, activation, and thrombosis. Blood, 140, 2477-2489, 2022. doi: 10.1182/blood.2022015568.
2019年
- Elsesser O, Fröb F, Küspert M, Tamm ER, Fujii T, Fukunaga R and Wegner M: Chromatin remodeler Ep400 ensures oligodendrocyte survival and is required for myelination in the vertebrate central nervous system. Nucleic Acids Res. 47:6208-6224, 2019
- Fröb F, Sock E, Tamm ER, Saur AL, Hillgärtner S, Williams TJ, Fujii T, Fukunaga R and Wegner M: Ep400 deficiency in Schwann cells causes persistent expression of early developmental regulators and peripheral neuropathy. Nat Commun. 10:2361, 2019
2015年
- Cendrowski J, Sánchez-Arévalo Lobo VJ, Sendler M, Salas A, Kuhn J-P, Molero X, Fukunaga R, Mayerle J, Lerch MM, and Real FX: Mnk1 is a novel acinar cell-specific kinase required for exocrine pancreatic secretion and response to pancreatitis in mice., Gut 64:937-947, 2015
2014年以前
- Panja D, Kenney JW, D'Andrea L, Zalfa F, Vedeler A, Wibrand K, Fukunaga R, Bagni C, Proud CG, Bramham CR: Two-stage translational control of dentate gyrus LTP consolidation is mediated by sustained BDNF-TrkB signaling to MNK., Cell Rep. 9:1430-45, 2014
- Gorentla BK, Krishna S, Shin J, Inoue M, Shinohara ML, Grayson JM, Fukunaga R, Zhong XP: Mnk1 and 2 are dispensable for T cell development and activation but important for the pathogenesis of experimental autoimmune encephalomyelitis., J. Immunol. 190:1026-1037, 2013
- Shi Y, Frost P, Hoang B, Yang Y, Fukunaga R, Gera J, Lichtenstein A: MNK kinases facilitate c-myc IRES activity in rapamycin-treated multiple myeloma cells., Oncogene 32:190-197, 2013
- Sharma B, Joshi S, Sassano A, Majchrzak B, Kaur S, Aggarwal P, Nabet B, Bulic M, Stein BL, McMahon B, Baker DP, Fukunaga R, Altman JK, Licht JD, Fish EN, Platanias LC: Sprouty proteins are negative regulators of interferon (IFN)-signaling and IFN-inducible biological responses., J. Biol.Chem. 287:42352-42360, 2012
- Fujii T, Ueda T, Nagata S, Fukunaga R: Essential role of p400/mDomino chromatin-remodeling ATPase in bone marrow hematopoiesis and cell-cycle progression., J. Biol. Chem. 285:30214-30223, 2010
- Ueda T. Sasaki M, Elia A J, Chio I I, Hamada K, Fukunaga R, Mak T W: Combined deficiency for Mnk1 and Mnk2 delays tumor development., Proc. Natl. Acad. Sci. USA. 107:13984-13990, 2010
- Iida S, Watanabe-Fukunaga R, Nagata S, Fukunaga R: Essential role of C/EBPα in G-CSF-induced transcriptional activation and chromatin modification of myeloid-specific genes., Genes Cells 13: 313-327, 2008
- Ueda T, Watanabe-Fukunaga R, Ogawa H, Fukuyama H, Higashi Y, Nagata S, Fukunaga R: Critical role of the p400/mDomino chromatin-remodeling ATPase in embryonic hematopoiesis., Genes Cells 12: 581-592, 2007
- Watanabe-Fukunaga R, Iida S, Shimizu Y, Nagata S, Fukunaga R: SEI family of nuclear factors regulates p53-dependent transcriptional activation., Genes Cells 10:851-860, 2005
- Iida S, Kohro T, Kodama T, Nagata S, Fukunaga R: Identification of CCR2, flotillin, and gp49 genes as new G-CSF targets during neutrophilic differentiation., J. Leukoc. Biol. 78:481-490, 2005
- Ueda T, Watanabe-Fukunaga R, Fukuyama H, Nagata S, Fukunaga R: Mnk2 and Mnk1 are essential for constitutive and inducible phosphorylation of eukaryotic initiation factor 4E (eIF4E) but not for cell growth or development., Mol. Cell. Biol. 24:6539-6549, 2004
- Fukunaga R, Hunter T: Identification of MAPK Substrates by Expression Screening with Solid-Phase Phosphorylation. in “MAP Kinase Signaling Protocols” (Seger, R., Ed.)., Methods Mol. Biol. 250:211-236, 2004
- Ogawa H, Ueda T, Aoyama T, Aronheim A, Nagata S, Fukunaga R: A SWI2/SNF2-type ATPase/helicase protein, mDomino, interacts with myeloid zinc finger protein 2A (MZF-2A) to regulate its transcriptional activity., Genes to Cells 8:325-339, 2003
- Ogawa H, Murayama A, Nagata S, Fukunaga R: Regulation of myeloid zinc finger protein 2A (MZF-2A) transactivation activity through phosphorylation by MAP kinases., J. Biol. Chem. 278:2921-2927, 2003
- Fukumoto T, Watanabe-Fukunaga R, Fujisawa K, Nagata S, Fukunaga R: The Fused protein kinase regulates Hedgehog-stimulated transcriptional activation in Drosophila Schneider 2 cells., J. Biol. Chem. 27:38441-38448, 2001
- Jiang W, Jimenez G, Wells NJ, Hope TJ, Wahl GM, Hunter T, Fukunaga R: PRC1: a human mitotic spindle-associated CDK substrate protein required for cytokinesis., Mol. Cell 2:877-885, 1998
- Fukunaga R, Hunter T: MNK1, a new MAP kinase-activated protein kinase, isolated by a novel expression screening method for identifying protein kinase substrates., EMBO J. 16:1921-1933, 1997
- Fukunaga R, Ishizaka-Ikeda E, Nagata S: Growth and differentiation signals mediated by different regions in the cytoplasmic domain of granulocyte colony-stimulating factor receptor., Cell 74:1079-1087, 1993
- Fukunaga R, Ishizaka-Ikeda E, Pan C-X, Seto Y, Nagata S: Functional domains of the granulocyte colony-stimulating factor receptor., EMBO J. 10:2855-2865, 1991
- Fukunaga R, Ishizaka-Ikeda E, Seto Y, Nagata S: Expression cloning of a receptor for murine granulocyte colony-stimulating factor., Cell 61:341-350, 1990
藤井 忍
2024年
- Shirai R, Shibata K, Fujii S, Fukunaga R, Inoue S: One-Step Affinity Purification of Leucine-Rich α2-Glycoproteins from Snake Sera and Characterization of Their Phospholipase A2-Inhibitory Activities as β-Type Phospholipase A2 Inhibitors. Toxins 16(3): 126-126 2024. doi: 10.3390/toxins16030126
2023年
- Fujii T, Inoue N, Nobeyama T, Inoue J, Ogasawara S, Otani Y, Fujii S, Ito C, and Fukunaga R: A simple, rapid, and efficient method for generating multigene-knockout culture cells by the CRISPR/Cas9 system. Genes to Cells, 28(5): 390-397, 2023. doi: 10.1111/gtc.13021.
2019年
- 藤井忍:Chap.2 ., レーニンジャーの新生化学[上]第7版., 廣川書店, 中山 和久(編集), p.61-101の翻訳, 2019
2015年
- 藤井忍:Chap.2 水., レーニンジャーの新生化学[上]第6版., 廣川書店, デービッド ネルソン, マイケル コックス(著), 川嵜 敏祐(監修), 中山 和久(編集), p.63-104の翻訳, 2015
2014年以前
- Ueoka R, Nakao Y, Fujii S, van Soest RWM, Matsunaga S: Aplysinoplides A-C, cytotoxic sesterterpenes from the marine sponge Aplysinopsis digitata., J. Nat. Prod. 71:1089-1091, 2008
- Furukawa A, Kita K, Toyomoto M, Fujii S, Inoue S, Hayashi, Ikeda K: Production of nerve growth factor enhanced in cultured mouse astrocytes by glycerophospholipids, sphingolipids, and their related compounds., Mol. Cell. Biochem. 305:27-34, 2007
- Hakogi T, Yamamoto T, Fujii S, Ikeda K, Katsumura S: Synthesis of sphingomyelin difluoromethylene analogue., Tetrahedron Letters 47:2627-2630, 2006
- Fujii S, Itoh H, Yoshida A, Higashi S, Ikezawa H, and Ikeda K: Activation of sphingomyelinase from Bacillus cereus by Zn2+ hitherto accepted as a strong inhibitor., Arch. Biochem. Biophys. 436:227-236, 2005
- Fujii S, Nagata M, Morita M, Minoura K, Tsukamoto K, Ikezawa H, Ikeda K: Novel inhibition mechanism of Bacillus cereus sphingomyelinase by beryllium fluoride., Arch. Biochem. Biophys. 424:201-209, 2004
- Obama T, Fujii S, Ikezawa H, Ikeda K, Imagawa M, Tsukamoto K: His151 and His296 are the acid-base catalytic residues of Bacillus cereus sphingomyelinase in sphingomyelin hydrolysis., Biol. Pharm. Bull. 26:920-926, 2003
- Fujii S, Ikeda K, Hayashi K: Catalytic and Toxicity Mechanisms of Secretory Phospholipase A2., Toxicol. Toxin Reviews 17: 279-313, 1998
伊藤 千紘
2023年
- Fujii T., Inoue N., Nobeyama T., Inoue J., Ogasawara S., Otani Y., Fujii S., Ito C., and Fukunaga R. A simple, rapid, and efficient method for generating multigene-knockout culture cells by the CRISPR/Cas9 system. Genes to Cells, 28(5): 390-397, 2023. doi: 10.1111/gtc.13021.
2022年
- Dong L., Muramatsu N., Numata H., Ito C. Functional analysis of a juvenile hormone inducible transcription factor, Krüppel homolog 1, in the bean bug, Riptortus pedestris. Zool. Sci., 39, pp562-569, 2022, DOI: 10.2108/zs220025
2021年
- Dong L., Udaka H., Numata H., Ito C.Regulation of Krüppel homolog 1 expression by photoperiod in the bean bug, Riptortus pedestris. Physiol Entomol, 46, pp82-93, 2021, DOI: 10.1111/phen.12347
2016年
- Ito C., Tomioka K.Heterogeneity of the peripheral circadian systems in Drosophila melanogaster: a review. Frontiers in Physiology, Frontiers Media, 7, 8.
2014年以前
- Ito C., Goto S. G., Numata H.Desiccation and heat tolerance of eggs of the Asian tadpole shrimp, Triops granarius. Zoological Science (The Zoological Society of Japan), 30, pp760-766.
- Ito C., Goto S.G., Tomioka K., Numata H. “Temperature entrainment of the circadian cuticle deposition rhythm in Drosophila melanogaster.” Journal of Biological Rhythms (SAGE), 2, pp14-23
- Ito C., Goto S.G., Shiga S., Tomioka K., Numata H. Peripheral circadian clock for the cuticle deposition rhythm in Drosophila melanogaster. Proceedings of the National Academy of Sciences of the United States of America (The National Academy of Sciences of the United States of America), 105, pp8446-8451.
著書
- Ito C. Peripheral circadian clock. In Insect Chronobiology (Eds Numata H., Tomioka K.), pp115-142., Singapore, Springer, 2023, doi: 10.1007/978-981-99-0726-7_6