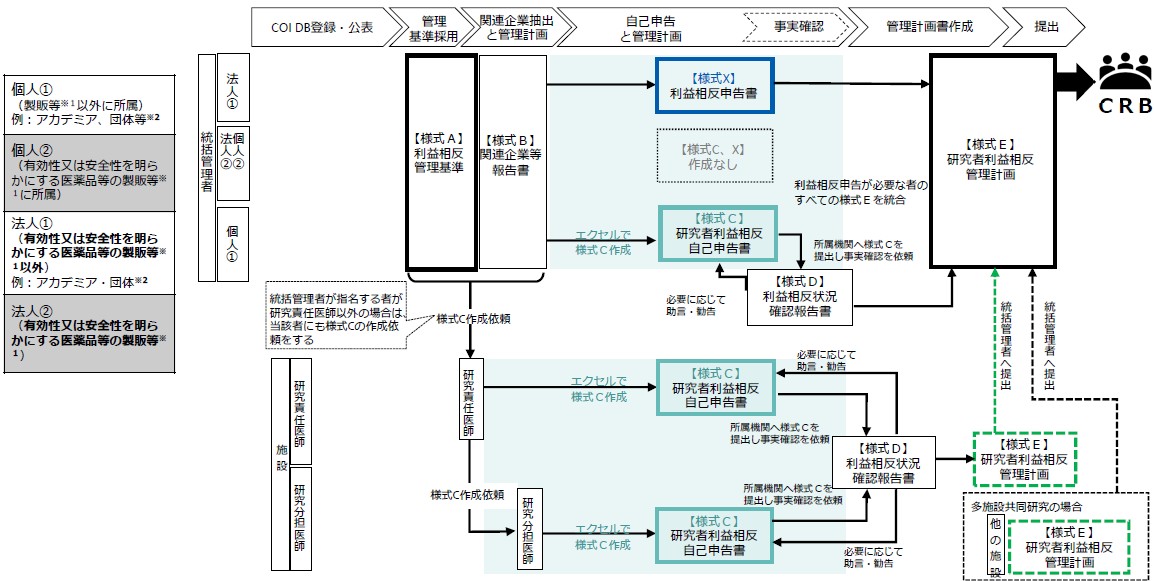
利益相反管理
※1 製販等:医薬品等製造販売業者又はその特殊関係者
※2 他社製品を扱う医薬品製造販売業者又はその特殊関係者を含む
利益相反管理の様式
| 様式名 | 作成者 | 内容 |
| 様式A 利益相反 管理基準 |
統括管理者 | COIを管理するにあたっての基準を記載する (推奨基準はあらかじめ記載されている) |
| 様式B 関係企業等 報告書 |
統括管理者 | 当該研究に関与している企業を確認し、 その管理計画を作成する (作成に際しては、各共同研究機関の研究責任医師に 対して、関係企業報告書に記載した関係企業等に齟齬が ないことを確認する) |
|
様式C |
統括管理者※3 |
当該研究に用いる医薬品等の製造販売企業等とのCOIを 確認しその管理計画を作成する |
|
様式X
利益相反
申告書 |
統括管理者※5 | 対象医薬品等製造販売業者等からの寄附金・一般寄附金・学会等寄附金・学会等共済費の申告書(様式X)を作成する。 |
| 様式D 利益相反状況 確認報告書 |
所属機関 (利益相反委員会事務局) |
提出された申告内容について事実確認を行い、必要に応じて 申告者に助言・指導を行う。 |
| 様式E 利益相反 管理計画 |
統括管理者 分担施設の研究責任医師 |
作成研究に関与するすべての医師の【様式C】及び【様式D】 の内容を確認し利益相反管理計画を作成する。 (分担施設の研究責任医師は、利益相反管理計画を作成後、 統括管理者へ提出する) |
※3 統括管理者が当該臨床研究の対象医薬品等製造販売業者及びその特殊関係者に属する個人の場合不要
※4 医学に関する知識に基づく必要な助言を求めることができる者(統括管理者が医師等でない場合適用)
※5 統括管理者が(医薬品等製造販売業者又はその特殊関係者を除いた)法人又は団体である場合
利益相反管理の対象
<対象>
・統括管理者
・研究責任医師
・研究分担医師
・統計解析責任者
・研究実施によって利益を得る事が明白な者
・医学に関する知識に基づく必要な助言を求めることができる者
<管理が必要となる利益相反>
・研究への企業関与
・利益相反申告者と企業との関係
参考
・厚生労働省「臨床研究法における臨床研究の利益相反管理について」
・厚生労働省「臨床研究法における利益相反管理ガイダンスに関する Q&A」
・厚生労働省「臨床研究法における利益相反管理に関する標準業務手順書」
・厚生労働省「臨床研究法における利益相反管理ガイダンスに関する Q&A」
・厚生労働省「臨床研究法における利益相反管理に関する標準業務手順書」
