治験とは
治験とは
臨床研究 ? 臨床試験 ? 治験 ? それなーに ??
皆さんは、ニュースや新聞記事で「臨床研究」「臨床試験」「治験」等の言葉を聞かれたことがありますか。
特にコロナ禍ではコロナウィルスに対するワクチンの「治験」の話は記憶に残っている方も多いと思います。
実際にご自身の診察時に「臨床研究」「臨床試験」「治験」の話をされた方もおられると思いますが、これらはよく似た表現で、違いが分からない方が大多数かと思います。内容がよくわからないまま同意されていませんか?
それぞれ、一体どんなものなのでしょうか。
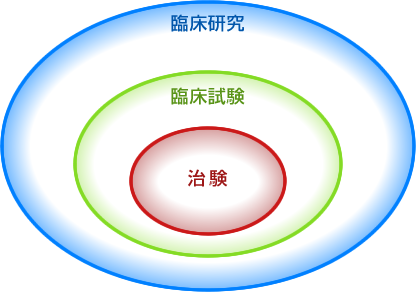
《臨床研究とは》
人を対象として医療における疾病の予防方法、診断方法及び治療方法の改善、 疾病病原および病態の理解並びに患者の生活の質の向上を目的として実施される医学系研究のすべてです。
《臨床試験とは》
人を対象に「新しい治療法や診断法の有効性や安全性」を調べる研究です。
《治験とは》
「薬の候補」を用いて、国(厚生労働省)から医薬品としての承認を得るために行う臨床試験です。
つまり、医師が処方箋を用いてお渡しする薬剤、標準治療で使用されている薬剤は全て「治験」を終了し、国から承認を得たものです。
治験について
薬が世の中で広く使われるようになるまでには、長い年月をかけて様々な試験を行い、薬の効果や安全性(副作用)を検討し、人々の健康や新しい治療に役立つことが証明されなければなりません。そして病気の治療に役立つことが証明されたものだけが厚生労働省から薬(医薬品)として認められ、世に出るようになります。
製薬会社は新しい薬を世に出すまでに数多くの研究や試験を行います。まず、動物を用いて「薬の候補」の効果と安全性を詳しく調べます。次に健康な人や患者さんに使用していただき、人での効果と安全性を調べます。
このような、人での効果と安全性を調べる試験のことを「臨床試験」といいます。その中でも厚生労働省から薬として認めてもらうために、患者さんのご協力のもとに行われる臨床試験のことを『治験』と呼びます。治験には、製薬会社が主体となって行う「治験」と、医師が自ら計画を立て医師が主体となって行う「医師主導治験」があります。この治験は製薬会社が主体となって行う「治験」に該当します。また、治験で患者さんに使用していただく「薬の候補」のことを『治験薬』といいます。
現在広く使われている薬も過去に多くの患者さんのご協力をいただきながら治験という研究的な段階で調べられ、厚生労働省から薬(医薬品)として認められてきました。このように、善意で治験に参加してくださった方々のご協力によって、医学の進歩や病気に対する新しい治療法の確立がなされています。
治験ってどうやって進めるの ?
| 〈試験の段階〉 | 〈対象者〉 | 〈目 的〉 |
|---|---|---|
| 基礎研究/動物試験 | 化合物/動物 | 研究者が多くの化合物の中から「薬の候補」を見つけ出し、それを動物(マウスやモルモット、サル等)に実際に投与して効果や安全性を確認する試験 |
| 第Ⅰ相 ※ここからがヒトを 対象にする治験です |
健康な人 (抗癌剤の場合は患者さん) |
治験薬の安全性と、ヒトの体での吸収や代謝や排泄のされ方を調べるための試験 |
| 第Ⅱ相 (探索試験) |
少数の患者さん | 治験薬の安全性と効果に関しておおよその見当をつけるための試験 |
| 第Ⅱ相 (検証試験) |
少数の患者さん | 最適な治験薬の使用量などを見出すための試験 |
| 第Ⅲ相 | 多くの患者さん | 多くの患者さんを対象に治験薬の安全性と効果を確かめるための試験 |
| 厚生労働省の審査 | 基礎研究からここまで来るのに10年~15年、 長いものでは20年ほどかかります |
|
| 承認 | 薬として承認後に薬価が決まり、医師が処方できることで一般に広く使われるようになります | |
| 第Ⅳ相 | 患者さん | 実際の診療の場における安全性と効果を調べる試験 |
また、『治験』は国が定めたルール(医薬品の臨床試験の実施の基準に関する省令:GCP省令)を守って、治験審査委員会の承認を得て行われます。治験審査委員会とは、当院における治験の内容を医学的な面だけでなく、倫理面や患者さんの安全性や福祉、人権の保護についても検討する組織です。当院における治験は全て治験審査委員会の承認を得たうえで行われ、この治験を継続して行うことの適否についても必要に応じて調査審議しております。
当院では、治験審査委員会の手順書、委員名簿、委員会の審議記録の概要などの情報を公開しておりますので、お知りになりたい場合は、治験相談窓口の臨床研究センターまでお問い合わせください。なお、これらの情報についてはホームページ上でも掲載しておりますので、ご参照ください。
- 名 称:大阪医科薬科大学病院治験審査委員会
- 設置者:大阪医科薬科大学病院 病院長
- 所在地:〒569‐8686 大阪府高槻市大学町2番7号
- ホームページアドレス:https://www.ompu.ac.jp/u-deps/crc/

