生体内含硫小分子への硫黄運搬・分配機構の解明
大阪医科薬科大学 生化学教室 講師
yumi.nakai(at)ompu.ac.jp
はじめに:含硫小分子における硫黄修飾
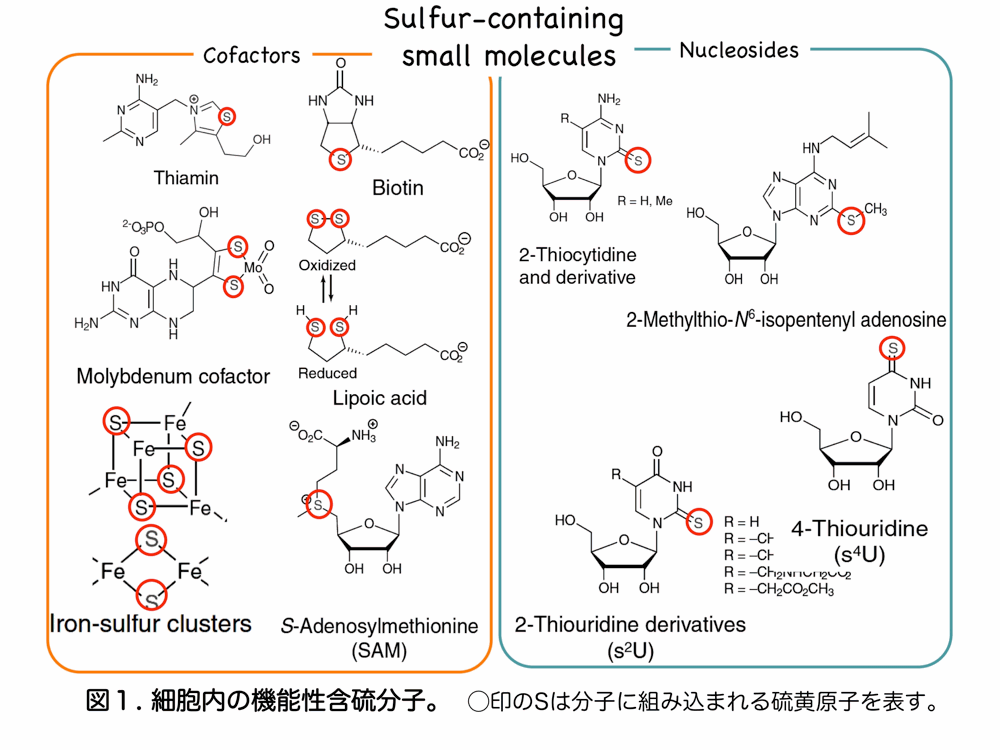
生体に不可欠な微量元素の一つである「硫黄」はタンパク質構造の保持や酸化還元反応を担うチオール基(–SH)の構成成分であり、チアミン・ビオチン等のビタミンや鉄硫黄クラスターなどの、いわゆる「含硫小分子」の構成成分でもあります。また、ヌクレオチドの転写後修飾により生成する機能性含硫ヌクレオチドも近年相次いで同定されています(図1)。
硫黄は、酸素と同じ第16原子族に属し、酸素より電子軌道が多様であることから、生物は、硫黄原子の電子の柔軟性をうまく利用して、重要な生体機能分子を生合成し様々な生体反応に用いています。例えば含硫アミノ酸であるシステインのチオール基を介したジスルフィド(–S–S–)の形成は、タンパク質の構造の安定だけでなく、機能的にも重要です。また、酵素活性部位に存在する含硫小分子の硫黄原子は基質との反応で電子の授受を担います。
分子内に硫黄原子が組み込まれている含硫小分子(図1)の多くが、遊離のシステインから切り出された反応性の高い硫黄化学種、すなわち「活性型硫黄」に由来することがわかっています。しかしその生合成過程、つまり「活性型硫黄」が最終的に分子に組み込まれるに至る機構は非常に複雑です。
システインデスルフラーゼ:含硫小分子への硫黄供給酵素
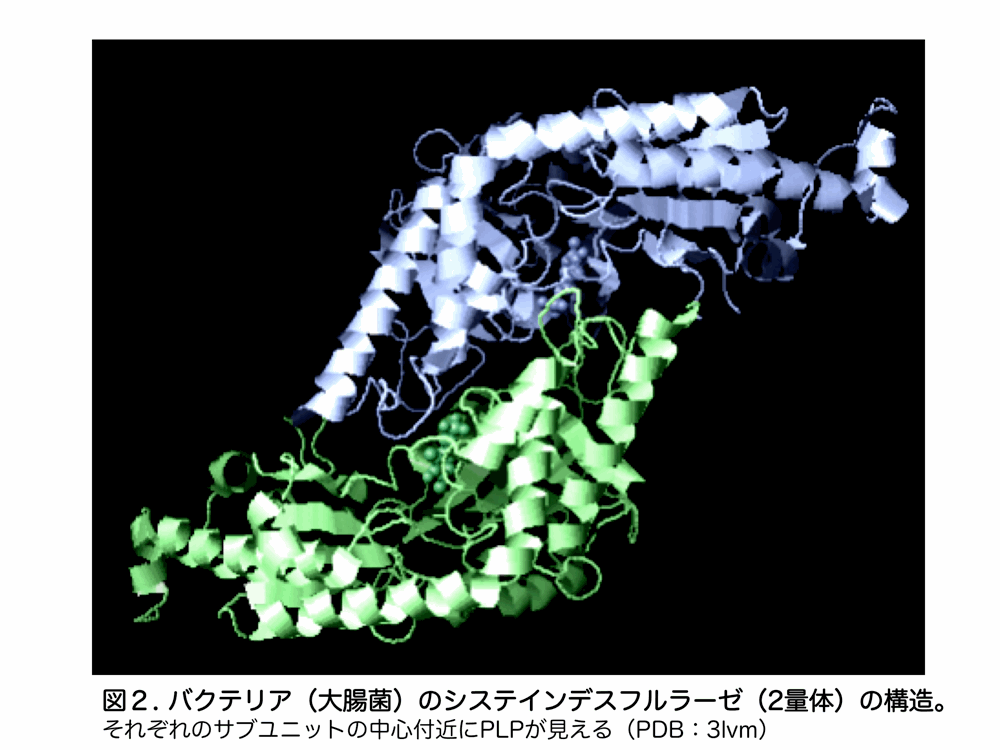
システインデスルフラーゼ(Cysteine desulfurase; 真核生物では Nfs1 と呼ばれる)はピリドキサル5’リン酸(PLP)を補酵素に持ついわゆる B6 酵素です(図2)。B6 酵素はそれぞれの酵素におけるシッフ塩基の位置や配向でアミノ基転移反応・脱炭酸反応・脱離反応など異なる機能を担います。システインデスルフラーゼの PLP は基質システインを保持し、酵素内の活性システイン残基が基質の硫黄原子を引き抜いてペルスルフィド中間体(-S-S-)を形成し、この「活性型硫黄種」が様々な相手方タンパク質に渡され、運搬されて最終的に含硫分子に構築されます。最初に見出されたシステインデスルフラーゼは、窒素固定細菌 Azotobactor vinelandii の窒素固定関連遺伝子オペロンに存在している NifS(Nitrogen Fixation protein S)で、ニトロゲナーゼ生合成タンパク質の1つです。ところが、その後バクテリア全般の鉄硫黄クラスター生合成オペロンにも NifS オルソログは広く見出され鉄硫黄クラスター生合成に必須であることがわかり、これらは IscS と呼ばれました。
私たちは、この酵素がバクテリアのみならずより広汎な生物に存在する硫黄供給酵素ではないかと考え、いち早く、真核生物にもシステインデルスフラーゼ(Nfs1)が存在し、かつそれは主にミトコンドリアのマトリクス画分に存在することを明らかにしました1)。さらに酵母 Nfs1 上核移行シグナル様アミノ酸配列を示す部位が生育に必須であることも示唆しています2)。真核生物のミトコンドリアにおける Nfs1 の存在は真核生物全般に共通していることが現在では知られています。しかしながら、ミトコンドリア外 Nfs1 タンパク質の存在と機能には依然議論があり、酵母では細胞質には存在しないと考えられていますが、哺乳類細胞では細胞質に存在すると報告されています。
tRNAwobble 位ウリジンの硫黄修には Nfs1 が必須である
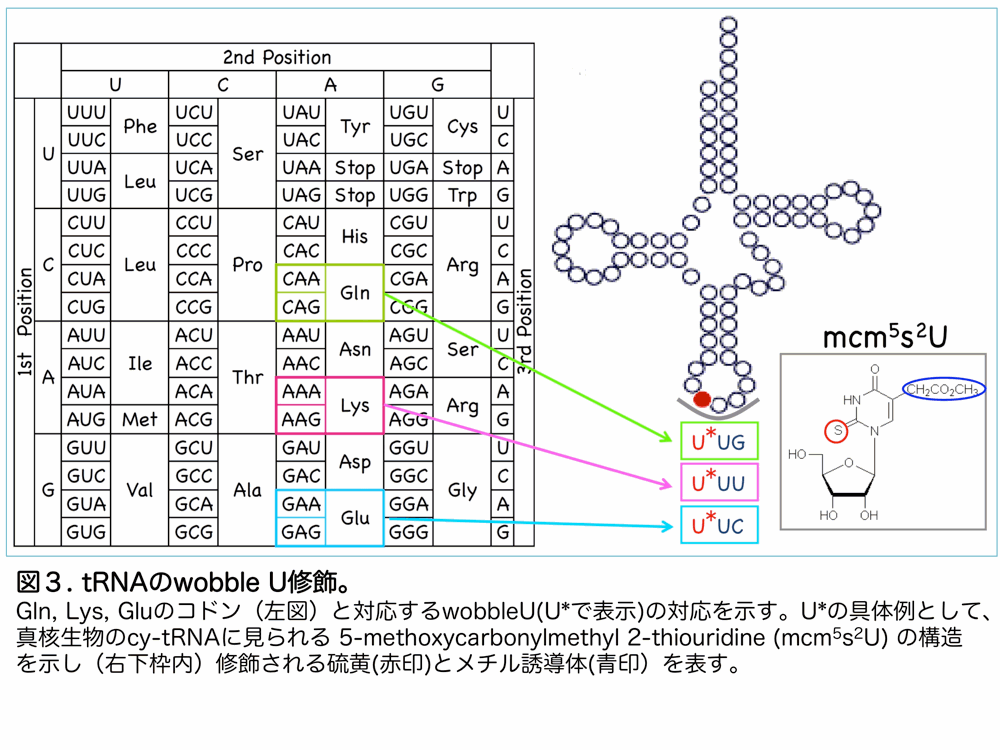
含硫小分子には、チアミンやビオチンなどのビタミンや鉄硫黄クラスターの他に修飾ヌクレオチドがあります(図1)。現在では100種類以上の修飾ヌクレオチドが tRNA、rRNA や DNA の塩基修飾として知られており(
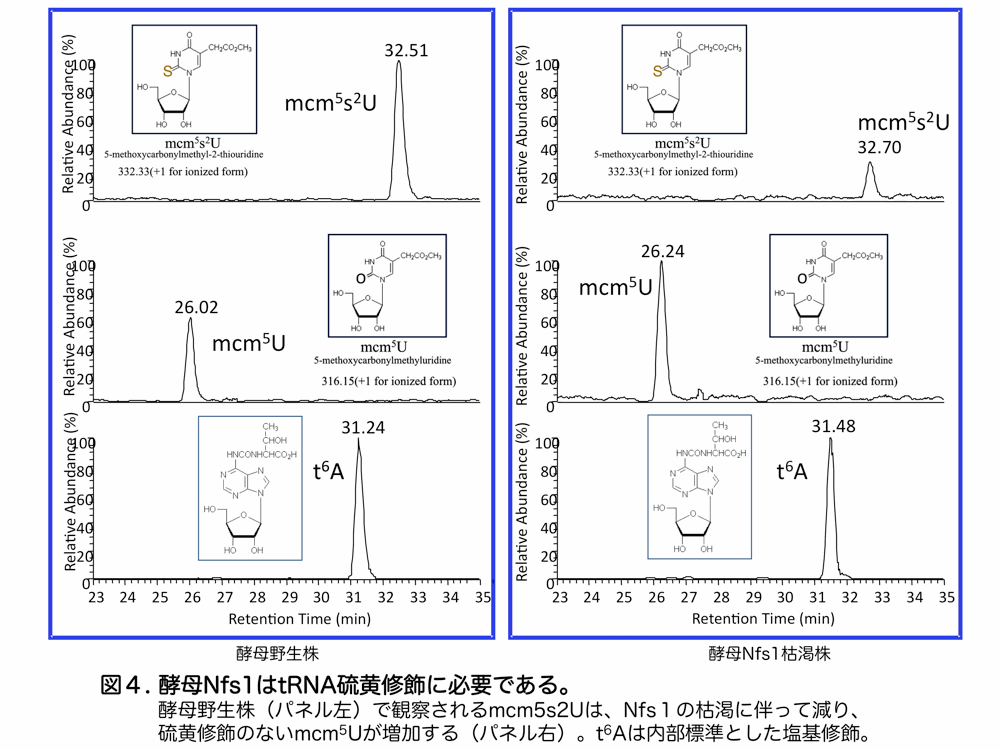
私たちは、先に述べた硫黄供給酵素 Nfs1 の硫黄供給酵素としての機能に着目し、Nfs1 が鉄硫黄クラスターのみならず、tRNAwobble 位ウリジンの硫黄修飾に必須であることを明らかにしました3)(図4)。この、ミトコンドリア Nfs1 による tRNA 硫黄修飾は酵母の cy-tRNA と mt-tRNA の双方に存在します。Nfs1 の枯渇に伴って mt-tRNA の方が cy-tRNA より先に修飾されなくなることから酵母ミトコンドリアの Nfs1 の関与が示唆されます。
細胞質 tRNA の硫黄修飾と細胞質の鉄硫黄クラスター生合成
鉄硫黄クラスターは補欠分子族としてミトコンドリアの呼吸鎖複合体タンパク質に多く見られる一方、ミトコンドリア外でも細胞質や核に存在します。私たちは酵母のミトコンドリア外に局在する鉄硫黄タンパク質のクラスターの硫黄がミトコンドリアに存在する Nfs1 から供給されることを示しています4)。真核生物の鉄硫黄クラスター生合成経路には、ミトコンドリア内の生合成経路のタンパク質の一群(Iron-Sulfur Cluster (ISC) machinery)と、ミトコンドリア外の鉄硫黄クラスター形成に関わるタンパク質の一群(Cytosolic Iron-sulfur cluster Assembly (CIA) machinery)が存在します(図5)。
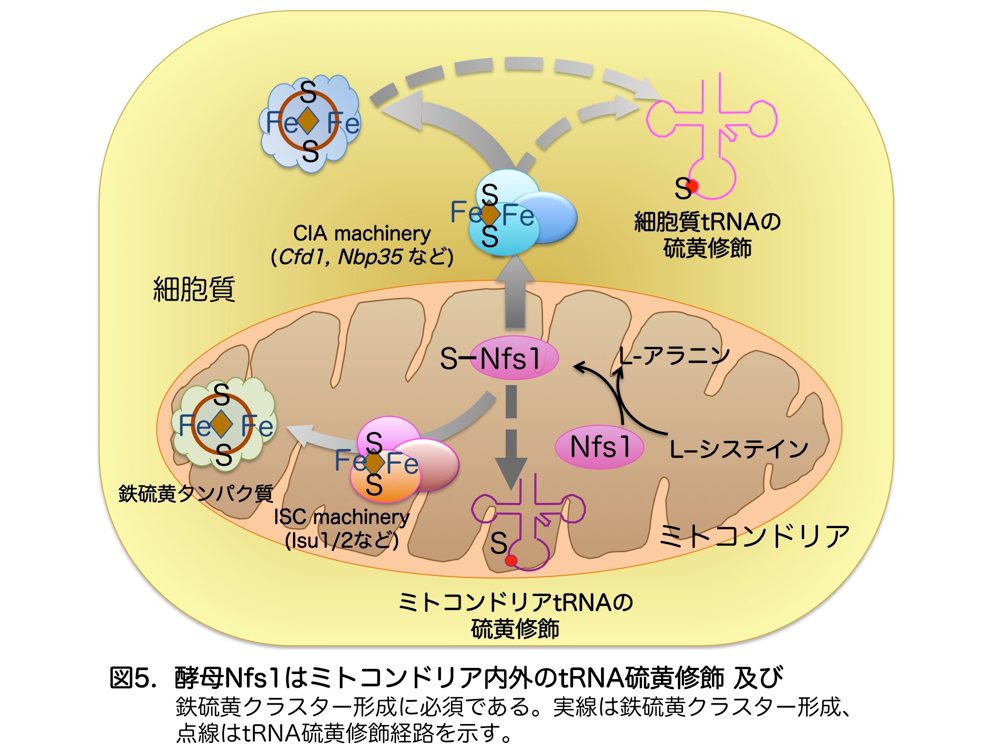
そこで、特に cy-tRNA への硫黄の細胞内運搬について、細胞質で鉄硫黄クラスター形成に関わる CIA machinery のタンパク質群が tRNA の硫黄修飾に関与するかどうか調べたところ、これに属する3種類のタンパク質(Cfd1, Nbp35, Cia1)はいずれも tRNA 硫黄修飾に必要であることを明らかにしました5)。一方、mt-tRNA の硫黄修飾はミトコンドリアの鉄硫黄クラスター生合成に必要な ISC machinery のタンパク質群とは異なるタンパク質の関与があることを明らかにしました5)(図5)。このように、鉄硫黄クラスターと cy-tRNA への硫黄供給経路は相互に関連し、細胞内での細胞内局在に応じて異なる機構が存在することがわかりました。
ユビキチン様タンパク質修飾システムと細胞質 tRNA の硫黄修飾
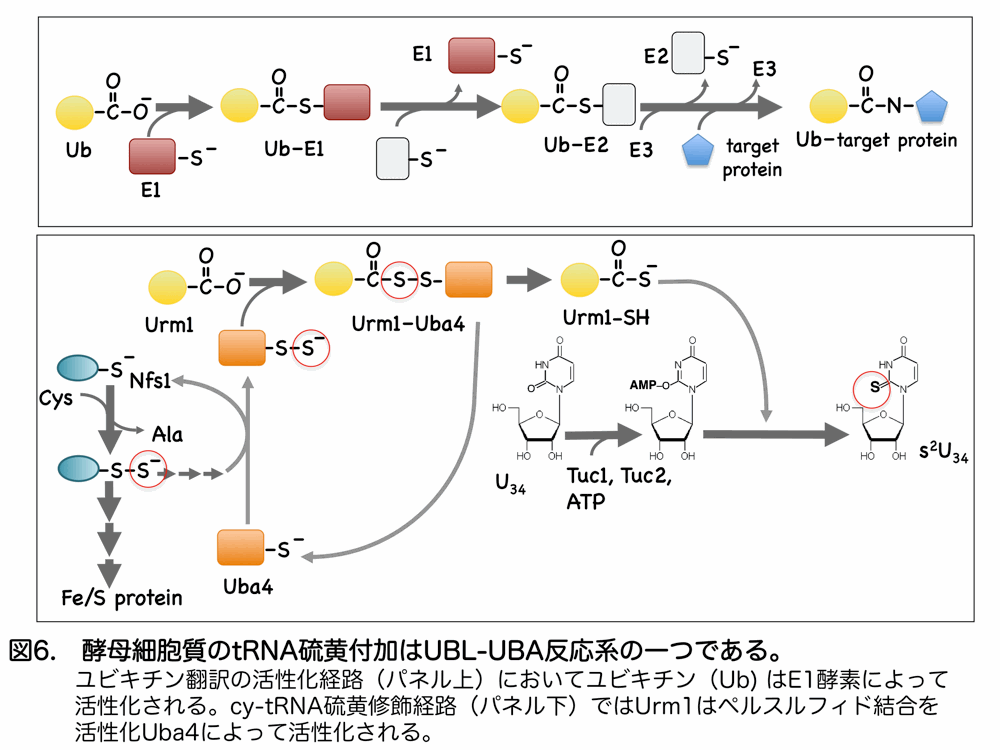
次に核酸結合モチーフ P-loop 構造の配列をもとに酵母遺伝子欠損株のライブラリースクリーニングを行なうことで、私たちは cy-tRNA 硫黄修飾に直接関与するタンパク質をいくつかの新たに同定することに成功しました6)。それらのうち Urm1 と Uba4 は、ユビキチンとそのパートナー分子であるユビキチン活性化酵素(E1)にタンパク質構造とそれぞれ類似し、いわゆるユビキチン様タンパク質(UBL; ubiquitin-like protein)と、その反応相手である E1 酵素様タンパク質(UBA; ubiquitin activating protein)との結合を端緒とする UBL タンパク質を介したタンパク質修飾系列(UBL-UBA反応系)と考えられました。私たちは、Urm1 のカルボキシル末端の二つのグリシン残基が重要であること、Uba4 と Urm1 が共存することが硫黄転移反応に重要であることから、おそらく UBA4 が Nfs1 や幾つかの硫黄運搬タンパク質を介して活性硫黄種をペルスルフィド結合中間体として保持し、これが Urm1 に移されるとのではないかと考えています。そしてこの Urm1-Uba4 間の酸素運搬反応は、バクテリアに進化的に古くから存在する硫黄運搬システムに由来するものであり、また現在真核生物のみに広くみられるユビキチンシステムの原型であると考えました(図6)。
酵母・動植物の cy-tRNA 硫黄修飾と MoCo 生合成の進化的意義
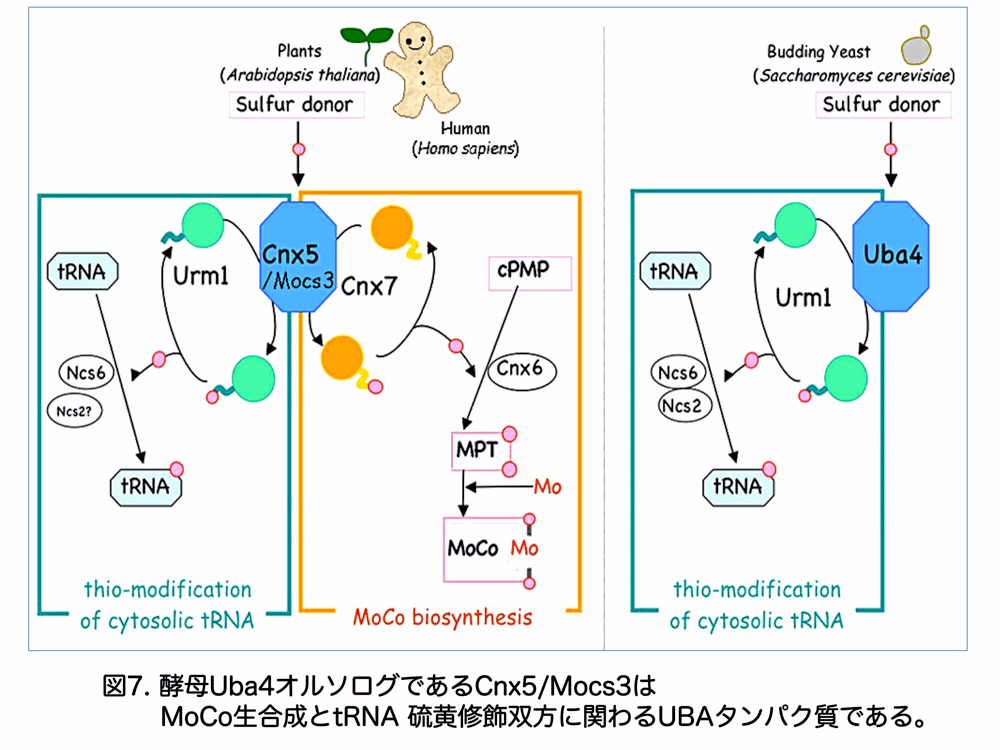
また、私たちは多細胞生物における cy-tRNA 硫黄修飾に関わる硫黄転移酵素 Uba4 の植物オルソログがCnx5であることを報告しました7)。モデル植物 Arabidopsis thaliana の Cnx5 はモリブデンを含む含硫小分子、モリブデンコファクター(MoCo)のモリブデン配位に必須の硫黄原子付加過程を触媒する酵素で Cnx5 欠損株は矮小型の幼少個体までしか生育できません。MoCo はヒトではモリブデンを含む唯一の補酵素として知られており、硫酸還元酵素やキサンチン酸化/脱水素酵素(XO/XDH)の活性中心として機能します。酵母の UBL-UBA 反応系である Urm1-Uba4 にヒントを得て MoCo 生合成経路にも UBL-UBA 反応系が存在するかどうか調べると、Cnx5 から硫黄を受け取って MoCo 前駆体である cPMP に硫黄を受け渡す Cnx7 が UBL であると考えられました。
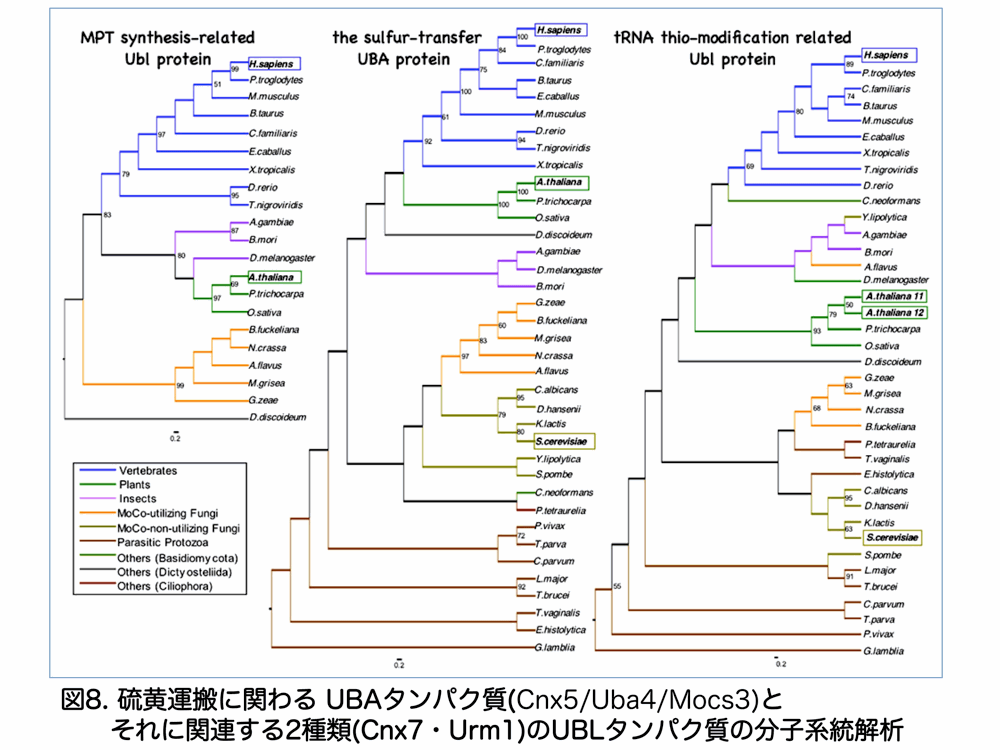
同様の MoCo 生合成経路はヒトなど動物細胞においても知られていることから、私たちは、硫黄運搬系の UBA タンパク質 Cnx5(動物の場合は Mocs3)は、MoCo 生合成・tRNA 硫黄修飾双方で異なる UBL タンパク質を使う硫黄転移酵素であると考えています(図7)。また、様々な生物のゲノムを調べると、UBA タンパク質である、硫黄転移酵素 Cnx5/Uba4/Mocs3(生物によって呼び名が異なる)は広範に存在する一方、相手方の UBL タンパク質としては Urm1 は Cnx5/Uba4/Mocs3 の存在する生物にはあるが一部の MoCo 生合成を欠落する Saccharomyces cerevisiae など一部の酵母や原生動物では Cnx7 に当たる UBL タンパク質は存在しないことがわかりました(図8)。
今後の方針
上記のように、私たちは真核生物 tRNA に付加される硫黄の運搬に関わるタンパク質群の同定とその機能解析を行なってきました。これまでシステインから硫黄を引き抜くシステインデスルフラーゼ Nfs1 の研究に端を発し、細胞質 tRNA・オルガネラ tRNA に共通するアンチコドンの wobble 位ウリジン硫黄修飾に着目して、その生成に関わる多くのタンパク質を明らかにしてきました。鉄硫黄クラスターや硫黄修飾核酸の成分となる硫黄原子が細胞内の様々な環境でどんなタンパク質を介してどのように授受されるのかの全貌解明に向けて研究を進めています。またこの修飾の欠失が細胞に及ぼす影響を多方面から解析しようと計画しています。
- Nakai Y, Yoshihara Y, Hayashi H, Kagamiyama H. FEBS Lett. (1998) 433: 143-148.
- Nakai Y, Nakai M, Hayashi H, Kagamiyama H. J Biol Chem. (2001) 276: 8314-20.
- Nakai Y, Umeda N, Suzuki T, Nakai M, Hayashi H, Watanabe K, Kagamiyama H. J Biol Chem. (2004) 279: 12363-8.
- Biederbick A, Stehling O, Rösser R, Niggemeyer B, Nakai Y, Elsässer HP, Lill R. Mol Cell Biol. (2006) 26: 5675-87.
- Nakai Y, Nakai M, Lill R, Suzuki T, Hayashi H. Mol Cell Biol. (2007) 27: 2841-7.
- Nakai Y, Nakai M, Hayashi H. J Biol Chem. (2008) 283: 27469-76.
- Nakai Y, Harada A, Hashiguchi Y, Nakai M, Hayashi H. J Biol Chem. (2012) 287: 30874-84.
