バイオフィルム形成機構
大阪医科薬科大学 生化学教室 講師
seiji.ishii(at)ompu.ac.jp
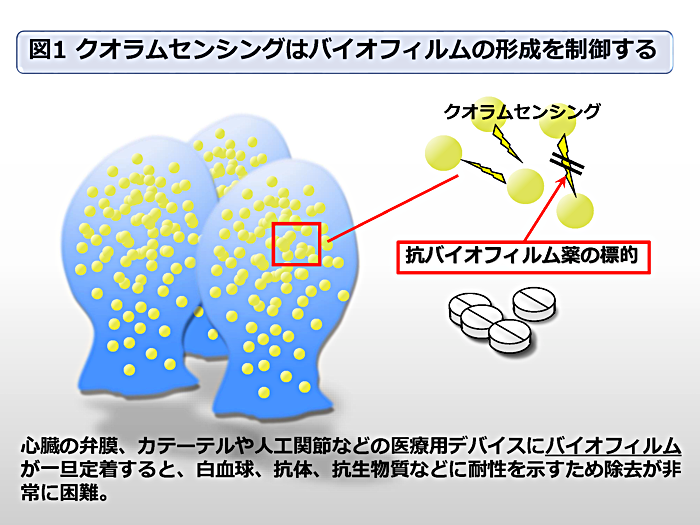
細菌が作るバイオフィルムは、現在治療が困難な感染症の大半に関与すると考えられています。私達は、クオラムセンシングのメカニズムがバイオフィルム形成に重要な役割を担っている事に着目し、レンサ球菌(口腔内の主要な常在菌)の ComA タンパク質の研究を行っています。ComA は、レンサ球菌のクオラムセンシングの初発段階で機能する ABC トランスポーターで、とりわけそのペプチダーゼドメイン(PEP)は、抗バイオフィルム薬開発の標的分子と考えられます(図1)。
私達は、まずクオラムセンシングのメカニズムが最も詳細に調べられているStreptococcus pneumoniae(肺炎球菌)の PEP と基質ペプチド ComC の発現系、精製方法、および活性測定法を確立し、その酵素学的諸性質を明らかにしました(Ishii S., et al., J. Biol. Chem. 281, 4726–4731, 2006)。
続いて他のレンサ球菌の PEP(計6種類)についても解析系を立ち上げ、各々の基質認識機構を比較したところ、レンサ球菌の PEP が共通の基質認識機構を持つことが示唆されました。そこで円二色性測定等を行った結果、基質 ComC の N 末リーダーペプチドが PEP と結合する際に両親媒性へリックスを形成し、高度に保存された疎水性残基が結合面に配向することを見出しました(Kotake Y., et al., Biochemistry 47, 2531–2538, 2008)。このような基質認識機構を有するプロテアーゼは極めて珍しく、PEP はタンパク質化学的にも興味深い研究対象です。

次に PEP の基質認識機構を精査するため、S. mutans(虫歯菌)の PEP の立体構造を高分解能で決定しました。わずか150残基からなる小さな PEP がどのようにして基質 ComC の N 末リーダーペプチドを認識するのか謎でしたが、この構造を元に作成した PEP–ComC 複合体モデルと変異型 PEP を用いた実験から、PEP のユニークな基質認識機構を具体的なイメージとして捉えることが出来るようになりました(図2)(Ishii S., et al., J. Biol. Chem. 285, 10777–10785, 2010)。
ところで、ComA には PEP の他に機能上重要なヌクレオチド結合ドメイン(NBD)が存在します。このドメインは ABC トランスポーターに特徴的で、ATP 加水分解によりリガンド輸送の駆動力を提供します。私達はこれまで定義が曖昧であった ABC トランスポーターの膜貫通領域と NBD の境界を機能解析および結晶構造解析の結果から提唱しました(Ishii S., et al., Biochemistry 52, 2545–2555, 2013)。
グラム陽性菌のクオラムセンシングの主要タンパク質は大半が膜タンパク質で、これまで系統的な生化学研究が殆どありませんでした。私達が蓄積した ComA タンパク質に関するデータは、PEPに対する分子標的創薬を進めて行くうえで大変有用な情報になります。得られる化合物は、口腔ケアおよび感染性心内膜炎などのレンサ球菌に起因するバイオフィルム感染症に対する有効な予防・治療薬として応用が期待されます。
バイオフィルム(Biofilm)とは?
細菌が形成するスライム状の多糖類からなる集合体。細菌が、一旦我々の体内でバイオフィルムを形成すると宿主の白血球や抗体および抗生物質に対して耐性を示すようになる。そのため、現在有効な予防・治療薬がなく医療分野での克服課題となっている。
クオラムセンシング(Quorum-sensing)とは?
細菌に広く存在する細胞 — 細胞間情報伝達機構。このメカニズムは、自分と同種の菌の生息密度を感知し、それに応じて物質の産生をコントロールする。バイオフィルム形成に重要であることからバイオフィルム感染症に対する創薬のターゲットと考えられている。
