スフィンゴ脂質代謝酵素
大阪医科薬科大学 生化学教室 准教授
hiroko.ikushiro(at)ompu.ac.jp
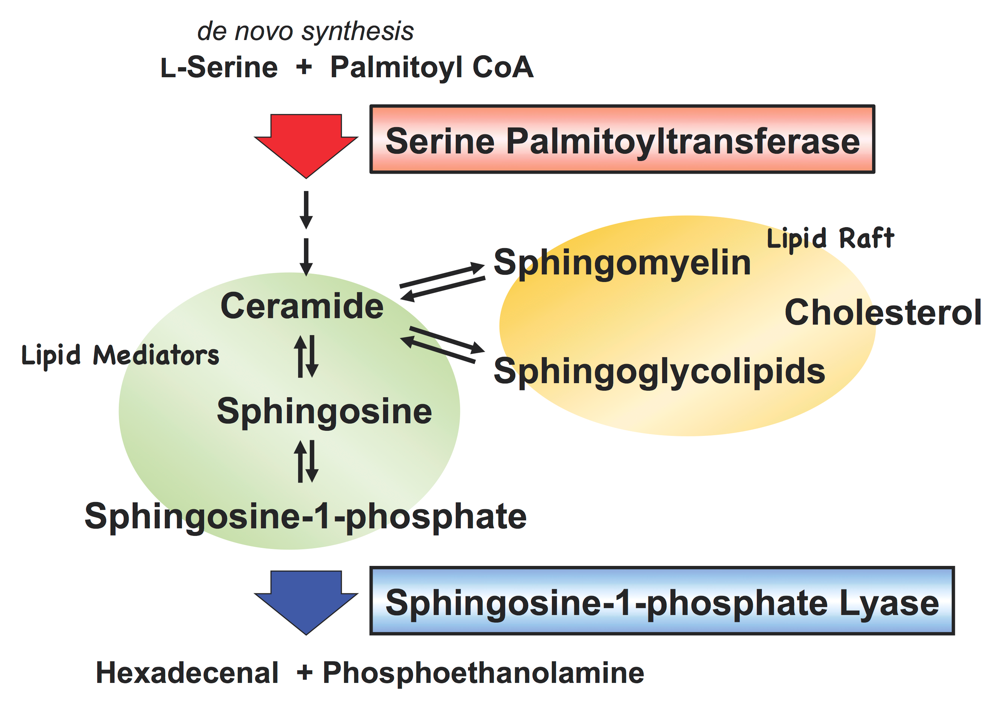
スフィンゴ脂質はグリセロリン脂質と同様に真核生物に遍在する膜脂質であり,細胞の生存には必須の成分である。代表的な代謝産物であるセラミドやスフィンゴシン,スフィンゴシン-1-リン酸は,それ自身が細胞内,細胞間の脂質メディエーターとして働き,増殖・分化・アポトーシスなど多彩な細胞機能に関与する。また,形質膜上に存在するスフィンゴミエリンやスフィンゴ糖脂質はコレステロールとともに脂質ラフト(lipid raft)と呼ばれるマイクロドメインを形成し,種々の情報伝達や膜輸送を介する特定の物質輸送の場として機能する(図1)。
スフィンゴ脂質のホメオスタシスは生合成・代謝経路を通して厳密に制御されているとされるが,その分子機構は未だ解明されていない。スフィンゴ脂質生合成系の酵素群の多くは取り扱いの困難な膜結合型タンパク質である。そのため,分子生物学的方法により構造遺伝子が同定されていながら,酵素本体を対象とした研究は依然として手付かずの状況にある。近年,脂質研究の分野では大型質量分析装置を駆使して,外界刺激に応答した細胞内スフィンゴ脂質の変動を網羅的に定性・定量解析するプロジェクトが進められている。そして,細胞内のスフィンゴ脂質の濃度や種類に影響する第一因子は個々の代謝酵素の活性変化であり,酵素レベルの研究の必要性が強く認識されている。筆者の研究の目標は,酵素タンパク質の立体構造に基盤をおいた反応機構解析によって,スフィンゴ脂質の生合成・分解の制御機構を分子レベルで明らかにすることである。これまで,生合成経路の初発律速酵素であるセリンパルミトイル転移酵素(serine palmitoyltransferase;SPT)と最終代謝産物スフィンゴシン-1-リン酸の分解反応を触媒するスフィンゴシン-1-リン酸リアーゼ(sphingosine-1-phosphate lyase;SPL)に注目して研究を進めている。
真核生物セリンパルミトイル転移酵素
SPT はピリドキサール-5′-リン酸(pyridoxal 5′-phosphate;PLP)を補酵素とし,L-セリンとパルミトイル-CoA を基質として,脱炭酸を伴う縮合反応によって3-ケトジヒドロスフィンゴシン(3-ketodihydrosphingosine;KDS)を生成する(図2a)。KDS は全てのスフィンゴ脂質の基本骨格であり,長鎖塩基(long chain base;LCB)とも呼ばれる。SPT の二つの基質が他の代謝経路によって共有されることや,細胞内で生じた KDS が蓄積することなく速やかにジヒドロスフィンゴシンへと変換されることから,この反応がスフィンゴ脂質生合成経路の律速段階と考えられている。SPT の活性変化が細胞内のスフィンゴ脂質の総量に直接影響することから,本酵素の活性制御機構を明らかにすることはスフィンゴ脂質ホメオスタシスを理解する上で大変重要である。
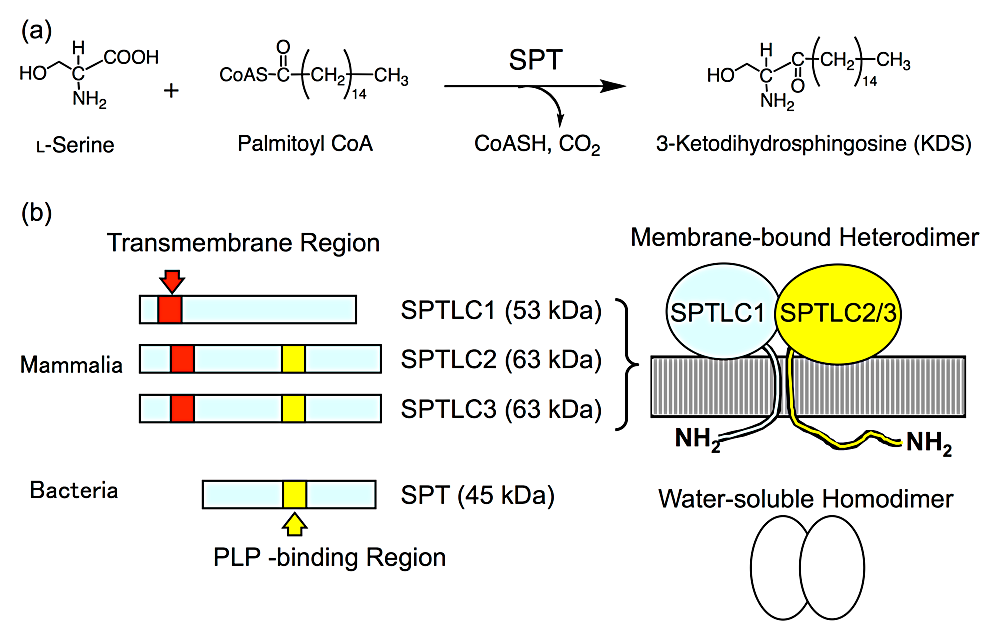
真核生物 SPT は小胞体膜上に局在する膜結合型タンパク質であり,活性部位を細胞質側に向けた配向をとっている(図2b)。哺乳動物に関しては,現在までに三つの SPT 遺伝子 SPTLC1,SPTLC2,SPTLC3 がクローニングされ,SPTLC1/SPTLC2,および SPTLC1/SPTLC3 ヘテロ二量体が酵素活性発現のための最小単位と考えられている。SPTLC2 と SPTLC3 には補酵素 PLP と Schiff 塩基を形成するリシン残基を含む SPT 特異的な PLP 結合モチーフが保存されているが,SPTLC1 の相当する領域には変異が蓄積しており,そのようなモチーフは存在しない。したがって SPTLC2 と SPTLC3 は活性ユニット,SPTLC1 は調節ユニットであると考えられている。真核生物SPTは細胞内での発現量が少ないうえに,膜結合型酵素ゆえの疎水的性質や安定性の低さのために組織から直接精製することは非常に難しい。また,大腸菌内で組換え酵素として発現させても不溶性の封入体を生じてしまう。真核生物 SPT の大腸菌や酵母内での発現系構築に取り組んでいる。
細菌 SPT は真核生物 SPT の原型としての細菌 SPT
—Sphingomonas paucimobilis EY2395T 由来 SPT の精製と SPT 遺伝子クローニング—
一般的に細菌はスフィンゴ脂質を含まないと考えられてきたが,一部の細菌については細胞膜成分として多量のスフィンゴ脂質を含むことが報告されており,これらの細菌がスフィンゴ脂質生合成経路を有すると期待された。そこで,種々のスフィンゴ脂質含有細菌についてスフィンゴ脂質合成活性を検索した結果,培養菌体の可溶性画分に SPT 活性を検出することができた。そのうちの一種,Sphingomonas paucimobilis EY2395T から SPT を精製し,遺伝子をクローニングした1)。さらに Sphingobacterium 属や Bdellovibrio 属の細菌の SPT 遺伝子もクローニングし,大腸菌内でのこれら細菌 SPT の大量発現に成功した2)。細菌 SPT は,一次構造上,真核生物 SPT の N 末端膜貫通領域を除いた残りの部分に対して高い相同性を示し,補酵素 PLP と Schiff 塩基を形成するリシン残基をはじめ酵素活性の発現に直接関与すると想定されるアミノ酸残基も保存されていた。細菌 SPT はいずれも真核生物の酵素とは異なり,水溶性のホモ二量体であった。細菌 SPT は真核生物 SPT の原型と考えられ,詳細な反応機構の解析を可能にする強力なモデル実験系が得られた。
細菌由来 SPT の酵素学的諸性質
精製酵素標品の安定供給により定常状態下の反応速度論的解析から基質に対する Km 値や酵素反応の kcat が算出され, 定量的な酵素反応解析が可能になった1)。真核生物 SPT は厳密な基質特異性を有し,アミノ酸は L-セリン,アシル CoA はパルミトイル-CoA(C16:0)のみを基質とし,アシル基の炭素鎖長がたった1つ変化する,あるいは不飽和結合が1ヵ所導入されただけでも,酵素活性が著しく低下する。一方,細菌 SPT の基質特異性はさほど厳密ではなく,特にアシル-CoA 基質については炭素鎖長 C12 から C20 まで,さらに不飽和結合が1つ導入された基質も遜色なく代謝した1)。また,真核生物 SPT は50 μM 以上のパルミトイル-CoA 濃度で著しい基質阻害を受けるが,細菌 SPT においては基質阻害は観測されなかった1)。スフィンゴ脂質含有細菌において生合成されるスフィンゴ脂質は菌体の外膜成分であり,若干の化学構造の変化は許容される可能性がある,むしろ多様なアシル CoA 基質を利用できる方が外界の変化に順応して細菌が生き延びる上では有利なのかもしれない。もともとホモ二量体であった SPT が進化の過程でヘテロ二量体化した理由は,基質特異性を厳格化し,基質阻害などの酵素活性制御機構を獲得するためではないかと推測している。
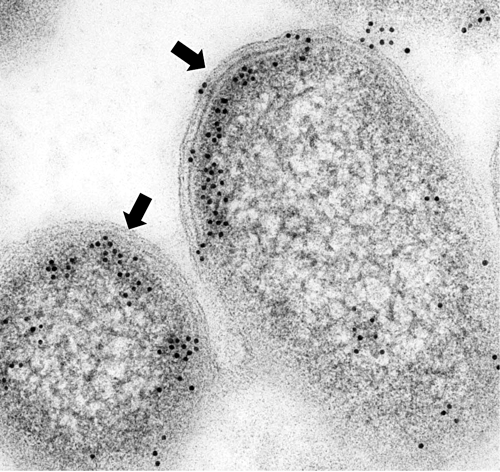
細菌 SPT は水溶性タンパク質として精製され,その基質である L-セリンおよびパルミトイル CoA は共に水溶性であるが,その反応生成物である KDS は水にはまったく溶けない脂質である。このことから,細菌 SPT の菌体内部での SPT の局在に興味が持たれた。抗 SPT 抗体を用いた免疫化学的解析から,SPT が菌体内膜近傍に限局分布することを明らかにした(図3)2)。細菌 SPT は菌体内では反応生成物を細胞膜中へ放出しやすいように,表在性膜タンパク質のようにゆるく膜に結合している可能性が示唆された。
また,精製標品を用いることで,種々の基質アナログに対する SPT の親和性(Kd 値)が簡易な実験によって測定できるようになり,これら化合物の阻害剤としての性能を定量的に評価できるようになった3)。これまで細胞生物学的実験系においてスフィンゴ脂質合成阻害剤として汎用されてきた一連の化合物と SPT の反応を解析して阻害機構を明らかにし,同時に,SPT による基質認識において,基質 L-セリンのカルボキシル基が大変重要であることを示した3)。
SPT 触媒反応素過程の解析
SPT は補酵素 PLP に由来する特徴的な吸収スペクトルを示し,その変化は活性中心における基質分子の化学的な状態変化を鋭敏に反映する。精製標品と基質の反応や,中間体を模した状態で反応停止するような化学構造を持つ基質アナログとの反応を様々な分光学的・物理化学的手法で解析することにより,SPT 触媒反応の素過程を詳細に調べることが可能である。SPT と L-セリンの結合過程に関して UV/vis 吸収スペクトル・円偏光二色性スペクトルの解析,およびストップトフロー法による遷移相の反応解析を行った結果,SPT に L-セリンが結合してミカエリス複合体を形成し,続く Schiff 塩基の交換反応によってPLP–L-セリン外アルジミン中間体を生成することを速度論的に証明した3)。
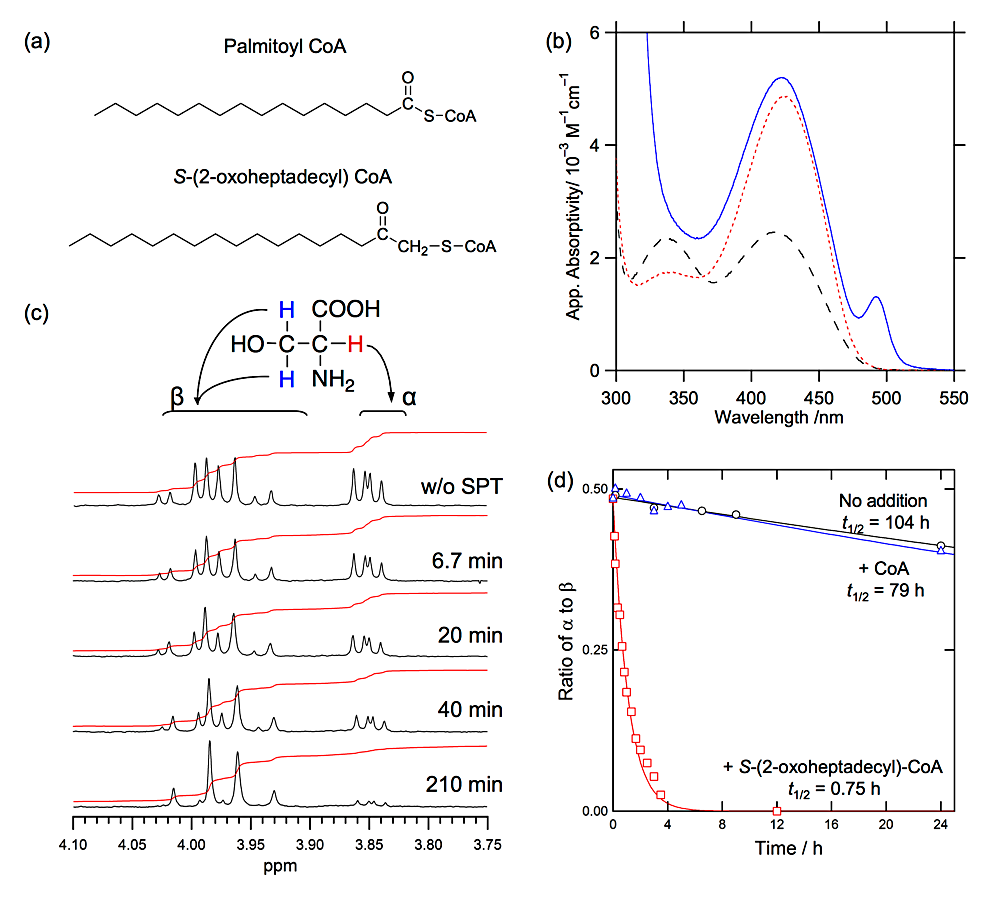
SPT の反応機構に関して,1960年代後半に2つの対立する仮説が提唱され,決着がついていなかった。1つは L-セリンの脱炭酸反応によってキノノイド中間体が生じ,次にアシル化が起こる反応経路であり,もう1つは L-セリンのα位の脱プロトン反応によってキノノイド中間体が生じ,アシル化と脱炭酸反応がその後に続く経路である。いずれが正しいのかを証明するため,SPT の2つめの基質であるパルミトイル-CoA の誘導体,S-(2-オキソヘプタデシル)-CoA を有機合成した(図4)。この誘導体は,パルミトイル-CoA のチオエステル部分にメチレン基を1個導入して求核置換反応が起こらないように設計した化合物である(図4)。SPT と L-セリン,S-(2-オキソヘプタデシル)-CoA の反応を 1H−NMR 法とストップドフロー法によって解析した結果,後者の経路によることを証明することができた4)。さらに,パルミトイル-CoA の酵素への結合によって L-セリンのα-脱プロトン反応(キノノイド中間体生成)が著しく促進される現象,いわゆる,基質協働性(substrate synergism)を SPT が示すことを新たに発見した4)。
SPT 立体構造決定と変異型酵素の解析で明らかになった活性部位ヒスチジン残基の多機能な役割
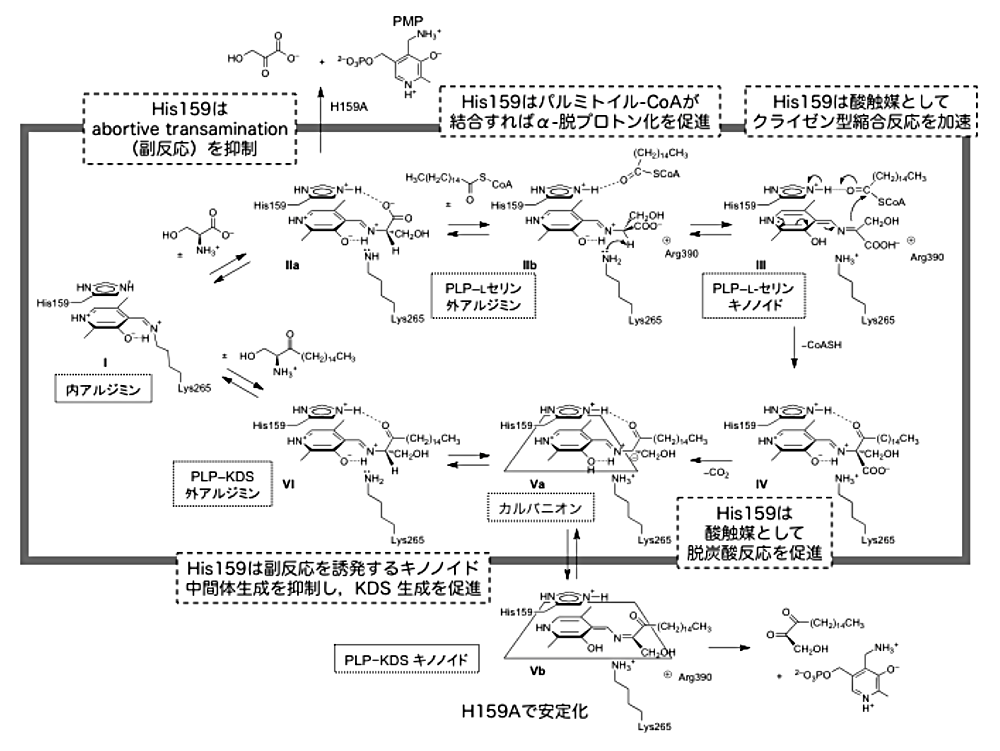
アミノ酸配列比較の情報から,SPT 活性部位の補酵素近傍にはヒスチジン残基(His159)が存在し,これが触媒基として SPT の反応機構上の重要な役割を担っていると予想された。そこで,この残基をアラニン残基や芳香族アミノ酸残基に置換した変異型酵素を作製してその反応を解析した5)。変異型 SPT 精製標品のうち,アラニン変異体(H159A)のみが酵素活性を維持していた。これは,His159 の側鎖が SPT の酵素活性「それ自体」には必須ではないという意味で予想に反する結果であった。野生型酵素と比較して H159A は L-セリンに対する親和性が著しく低下しており,His159 は L-セリンの結合に貢献していることが示された。H159A の反応を詳細に解析した結果,図5に示すように SPT の触媒機構と酵素活性部位の His 残基の多機能性を明らかにすることができた。すなわち,①L-セリンが SPT に結合すると Schiff 塩基交換反応を経て外アルジミン中間体が生じる。SPT の外アルジミン中間体では,他の一般的な PLP 酵素とは異なり,His159 によって L-セリンのカルボキシル基が固定される結果,α位水素の配向が PLP ピリジン環と Schiff 塩基が作る平面に対して垂直になれず,結果として中間体の脱プロトン化による副反応進行が抑制されている。②パルミトイル-CoA が結合すると,His159 との水素結合の組換えによって L-セリンのコンフォメーションが変化し,近傍の Lys265 によりα-プロトンが引き抜かれてキノノイド中間体が生じる。パルミトイル-CoA の有無による外アルジミン中間体のα-脱プロトン化の制御は,反応性の高いキノノイド中間体を無駄に作らない点で合目的的である。③縮合反応,CoA の解離と脱炭酸反応が進行して KDS が生じ,これが酵素から解離すると分子内 Schiff 塩基が再生する。全体を通して重要な役割を果たすのが His159 である。His159 は,活性部位における基質の配向だけでなく生成物の配向も酵素反応の進行に合わせて厳密に制御し,両者からの副反応の進行を抑制する。④His159 は一般酸触媒としても働き,炭素–炭素結合の形成および脱炭酸を促進している。
SPT においてみられる活性部位の His 残基による酵素活性発現の機構は一つのアミノ酸残基による反応制御として実に絶妙である。ところが,これらは非律速段階であるために,古典的な部位特異的変異解析では「変異による活性消失が認められないことから触媒性残基ではない」とされ,His159 の真の役割が理解されない。しかし,SPT 特異的な反応の進行を厳密に制御するためには His159 の多機能的役割は不可欠である。酵素反応の本当の制御機構を知るためには,触媒性残基のみならず反応特異性を司る残基を見出して解析することが重要であると思われる。
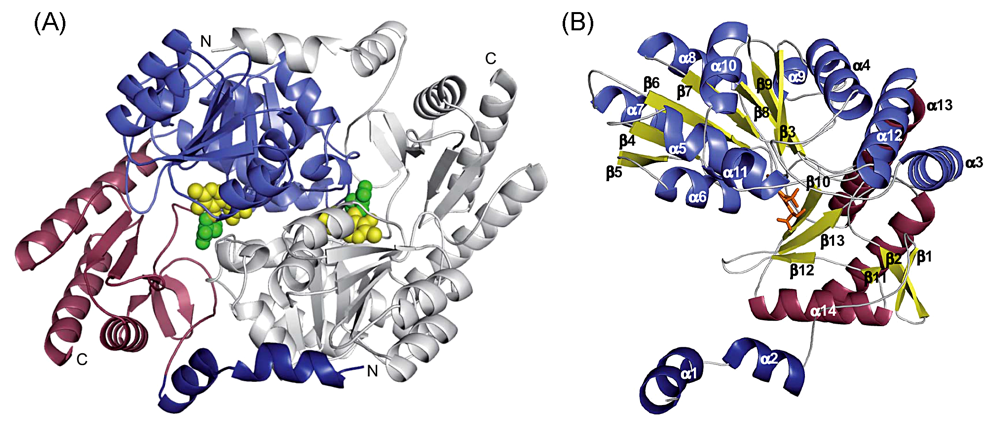
細菌 SPT の立体構造解析
反応機構解析と平行して進めてきた SPT–L-セリン複合体の結晶構造解析にも成功した6,7)(図6 A,B)。SPT の構造は PLP 酵素のフォールドタイプ I に分類され,結晶中では結晶学的二回軸を介した二量体を形成していた(図6a)。活性部位は両サブユニットの会合面に存在する。活性中心では,アミノ酸基質である L-セリンが結合し,そのアミノ基が補酵素 PLP と Schiff 塩基を形成していた。PLP のピリジン環は先述の His 残基側鎖とファンデルワールス相互作用をして存在していた。基質 L-セリンの水酸基は PLP のリン酸基および水分子と水素結合しており,カルボキシル基は His 残基の側鎖,および2個の水分子と水素結合していた。注目すべき点は,SPT 結合している基質 L-セリンのα-プロトンの配向が,一般的な PLP 酵素と異なることであった。この立体配置は基質のα位脱プロトン反応の進行を妨げると考えられ,前段で提唱した SPT の活性制御機構に対する構造的根拠が得られた8)。
ヒト遺伝性感覚ニューロパチー I 型の原因遺伝子としての SPT
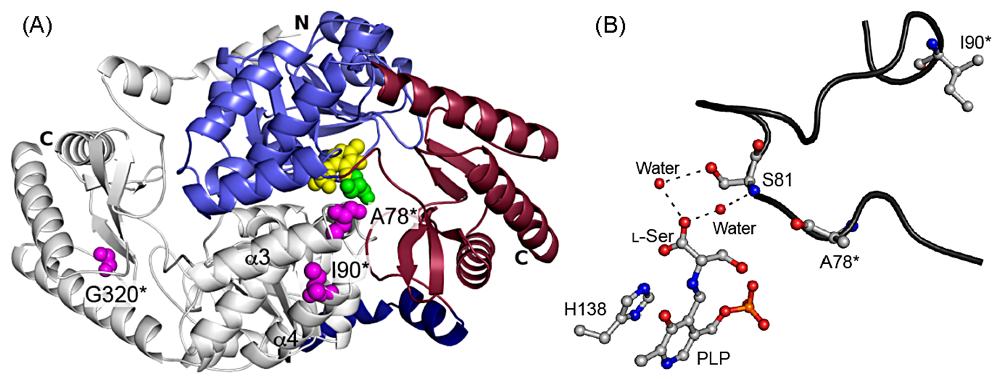
遺伝性感覚ニューロパチー(hereditary sensory neuropathy;HSN)は遺伝性で感覚神経系と自律神経系が様々な程度で障害される疾患である。現在1型(HSN1)から5型(HSN5)に分類されている。HSN1 のみが進行性であり,患者は20〜40歳代に繰り返す足底の潰瘍の臨床症状で発症し,高度の自発痛を伴う感覚障害,運動障害,発汗異常などの自律神経障害を呈し,重篤な場合には足部の切断に至る。海外では多くの症例報告があるが,日本国内での報告はないようである。2001年,HSN1 の原因遺伝子として SPTLC1 が同定された。翌年には酵母や培養細胞を用いた実験から HSN1 変異型 SPT は酵素活性を喪失しており,神経細胞の生存を維持できるだけのスフィンゴ脂質を供給できなくなる,いわゆる “loss of function” が病因とされた。しかし,HSN1 患者の血清ではスフィンゴ脂質合成活性がむしろ亢進している矛盾も観察された。細菌 SPT の立体構造に照らし合わせると,HSN1 型変異箇所(図7の I90*,A78*)は活性中心からかなり遠く,補酵素や基質分子と直接相互作用していなかった。変異箇所は,基質 L−セリンと水分子を介して相互作用する S81 残基を含むループ構造の根元部分に該当し,トリプトファンなどの嵩高いアミノ酸残基に置換されていた。ループの根元では小さな構造の歪みであっても,ループ先端部分には大きな動きを引き起こす可能性が高いと考えられた。このことから,筆者は,基質や補酵素と直接相互作用する位置にはない HSN1 型変異が間接的に作用して酵素の基質特異性を変化させ,結果生じた異常代謝物が病気を引き起こしているという “gain of function” の仮説を想定した7)。細菌 SPT は,生理的な濃度を大きく上回る高濃度のアラニンやグリシンとインキュベートすると,パルミトイル-CoA との縮合反応を触媒し,デオキシスフィンガニンやデオキシメチルスフィンガニンという異常長鎖塩基を生成することが判明した。これらの異常長鎖塩基に由来する異常セラミドは糖鎖付加やリン酸化されず,脂質メディエーター,ラフト成分としての生理機能を果たすことができないと考えられる。海外の研究チームによって HSN1 患者において上述の異常長鎖塩基が合成されていることが見出され,L−セリンの大量投与によって患者の症状緩和を目指す試みも行われている。ヒトの疾患変異型 SPT において基質認識がどのように変化しているのかを明らかにする目的で共同研究を進めている。
文献
- Ikushiro, H., Hayashi, H., & Kagamiyama, H. (2001) J. Biol. Chem., 276, 18249–18256.
- Ikushiro, H., Islam, M. M., Tojo, H., & Hayashi, H.(2007) J. Bacteriol., 189, 5749–5761.
- Ikushiro, H., Hayashi, H., & Kagamiyama, H. (2004) Biochemistry, 43, 1082–1092.
- Ikushiro, H., Fujii, S., Shiraiwa, Y., & Hayashi, H. (2008) J. Biol. Chem., 283, 7542–7553.
- Shiraiwa, Y., Ikushiro, H., & Hayashi, H. (2009) J. Biol. Chem., 284, 15487–15495.
- Ikushiro, H., Okamoto, A., & Hayashi, H. (2006) Sphingolipid Biology (Hirabayashi, Y., Igarashi, Y., & Merrill, A., Eds.) Springer-Verlag Tokyo/Japan pp. 483–492.
- Ikushiro, H., Islam, M. M., Okamoto, A., Hoseki, J., Murakawa, T., Fujii, S., Miyahara, I., & Hayashi, H. (2009) J. Biochem., 146, 549–562.
- Ikushiro, H., & Hayashi, H. (2011) Biochim. Biophys. Acta, 1814, 1474–1480.
